Prof. Blumes Tipp des Monats Oktober 2004 (Tipp-Nr. 88)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Was ist eine volumetrische Titration?
Volumetrie heißt "Abmessen von Volumina". Dahinter verbirgt sich eine der wichtigsten Tätigkeiten im chemischen Labor, die volumetrische Titration (franz. titrer, bestimmen des Feingehalts von Gold usw.). Man sagt auch Titrimetrie. Der deutsche Chemiker spricht von Maßanalyse. Damit kann man Konzentrationen von Stoffen in Lösungen bestimmen.
Betrachten wir einmal eine einfache Neutralisationsreaktion.
NaOH + HCl ———> NaCl + H2O
Zum Neutralisieren von 40 g Natriumhydroxid benötigt man zum Beispiel 36,5 g Chlorwasserstoffgas. Damit kann man nur schwer umgehen. Wie will man auch mal ganz schnell ein Gas abwiegen?
Erinnern wir uns: Bei der Reaktion reagieren ja Teilchen miteinander. Bei den Teilchen handelt es sich um Ionen, die in den Lösungen unabhängig voneinander vorliegen.
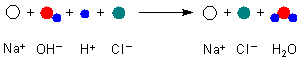
Es reagieren insbesondere nur Protonen und Hydroxid-Ionen. Die Natrium- und Chlorid-Ionen nehmen an dem Neutralisationsgeschehen nicht teil. Der Chemiker beschreibt das Geschehen wie folgt.
H+ + OH- ———> H2O
(Auf die meistens überflüssige, von vielen Lehrern leider so geliebte und von einem didaktischen Kinderfeind offenbar zur Verwirrung der Schüler erfundene H3O+-Formulierung für hydratisierte Protonen verzichten wir.)
Besser geeignet als die Grammeinwaage ist deshalb als Massenangabe eine Stoffportion, die zur Teilchenzahl proportional ist. Das ist das Mol. Ein Mol enthält 6 · 1023 Teilchen. Zur Neutralisation reagiert ein Mol "HCl-Teilchen" mit einem Mol "NaOH-Teilchen".
Folglich ist es logisch, als Maßeinheit zur Bestimmung von Konzentrationen Lösungen zu nehmen, die genau ein Mol des gelösten Stoffs oder ein Vielfaches davon enthalten.
Wie geht man bei der Maßanalyse vor?
Zunächst füllt man ein genau abgemessenes Volumen der zu titrierenden Substanz (z. B. der Säure) in einen
Weithals-Erlenmeyerkolben. Man sagt: "Wir legen die Säure vor". Titriert wird mit der Maßlösung, hier Natronlauge.
Die füllen wir in eine Bürette.
Jetzt fehlt nur noch ein Stoff, der uns signalisiert, wann die Titration beendet bzw. der Äquivalenzpunkt
erreicht ist. Das ist der Indikator (lat. Anzeiger), der dann
seine Farbe ändert, wenn der Äquivalenzpunkt ein wenig überschritten ist. Ein praktisch viel genutzter Indikator
ist das Phenolphthalein, der im sauren oder neutralen Milieu farblos ist,
im Alkalischen dagegen rot gefärbt ist.
Es gibt daneben natürlich physikalische Verfahren zur Bestimmung des Endpunkts einer Titration - wie die Temperatur, die elektrische Leitfähigkeit (Kurze Frage 831) oder der Wert der Spannung zwischen zwei Elektroden bei der Potentiometrie. Auf diese Methoden gehen wir hier nicht weiter ein.
Wir titrieren, indem wir die Maßlösung zutropfen lassen und dabei den Erlenmeyerkolben aus dem Handgelenk heraus kreisend schwenken. So vermischen sich die Lösungen gut.
|
Versuch 1: Titration von gleichmolaren Lösungen
|
Legen wir also 100 ml einer einmolaren Lösung von Salzsäure vor, so benötigen wir genau 100 ml einer einmolaren Natronlauge zum Neutralisieren. Denn beide enthalten ja die gleiche Teilchenzahl. Diese können wir sogar berechnen:
6 · 1023 Teilchen / 1000 ml = x Teilchen / 100 ml
x = 6 · 1022 Teilchen
Die Rechenvorschrift ist der klassische Dreisatz, der aber - glaube ich - leider in der Schule nicht mehr gelernt wird.
Die folgende Graphik zeigt das Prinzip an einmolaren Lösungen. Ein Symbol steht für 1022 Teilchen.
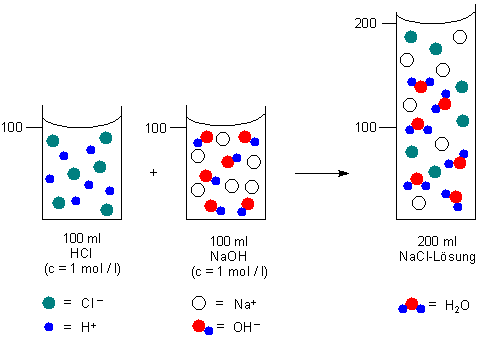
Grundsätzlich gilt: Gleiche Volumina gleichmolarer Lösungen enthalten gleichviel Teilchen.
Bei einer Lösung, die genau ein Mol einer Substanz gelöst enthält, sprechen wir von einer
einmolaren Lösung. Ihre Konzentration ist 1 mol / Liter. In ihren
Versuchsanleitungen schreiben Chemiker das ein bisschen umständlich: Salzsäure (c = 1 mol / l).
Natürlich kann man (wie schon erwähnt) statt eines einzigen Mols auch ein Vielfaches davon nehmen. Oder
einen Bruchteil, zum Beispiel ein Zehntel Mol. Im letzten Fall ist die Teilchenzahl nur 6 ·
1022, und wir nennen das eine 0,1-molare Lösung (oder c = 0,1 mol / l). Insgesamt
spricht man aber trotzdem noch von molaren Lösungen.
Wenn wir molare Lösungen verwenden, können wir anstelle von schwierigen Einwaagen zur Konzentrationsermittlung einfach handhabbare Volumina verwenden.
Zur Herstellung molarer Lösungen
Häufig wird der Fehler gemacht, dass man ein Mol des Stoffs in einem Liter Wasser löst. Das ist falsch,
weil es beim Lösen normalerweise zu stoffabhängigen Volumenveränderungen kommt und deshalb die Voraussetzung
der Volumetrie, dass gleiche Volumina gleichmolarer Lösungen auch gleiche Teilchenzahlen enthalten, nicht
mehr stimmt.
Richtig geht man so vor: Man löst in einem 1 Liter-Messkolben in etwa 750 ml Wasser die notwendige Menge an Substanz auf. Dann lässt man die Lösung gegebenenfalls auf Zimmertemperatur abkühlen und füllt mit Wasser auf genau einen Liter auf.

Helene beim Titrieren (Foto: Daggi)
Anwendungen der Maßanalyse
Wir können molare Lösungen als Standard- oder Maßlösungen nutzen, um unbekannte
Konzentrationen von Stoffen in anderen Lösungen zu ermitteln. Das ist so, als wenn wir
mit einem Maßband die unbekannte Länge eines Stücks Holz messen.
Gerade die Salzsäure ist ein gutes Beispiel für die Vorteile der Maßanalyse: Deren Konzentration ist oftmals schwer einzuschätzen, weil ihr Inhaltsstoff, der Chlorwasserstoff, ein flüchtiges Gas ist. Die Maßlösung, die Messlatte also, ist leicht herstellbare und stabile Natronlauge mit genau bekannter Konzentration.
|
Versuch 2: Titration einer Salzsäure unbekannter Konzentration
|
Zur Auswertung bedienen wir uns wieder einer einfachen Formel:
VSäure (ml) · [Säure] (mol / l) = VLauge (ml) · [Lauge] (mol / l)
Es bedeuten:
VSäure = Volumen der Vorlage an Säure (ml)
[Säure] = Konzentration der vorgelegten Säure (mol / l)
VLauge = Volumen der zugegebenen Lauge (ml)
[Lauge] = Konzentration der zugegebenen Lauge (mol / l)
Wenn wir genau hinsehen, beschreiben wir mit dem Produkt aus Volumen und Konzentration Teilchenzahlen. Rechts steht die Gesamtzahl der Laugenteilchen. Damit Neutralisation eintritt, muss links die Gesamtteilchenzahl der Säure gleich denen der Lauge sein. Man spricht auch vom chemischen Hebelgesetz.
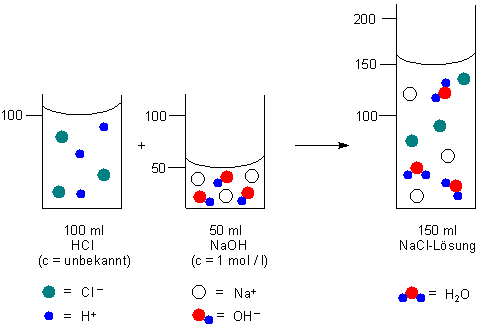
Zum Beispiel haben wir 100 ml Salzsäure mit unbekannter Konzentration vorgelegt und bis zur Neutralisation 50 ml Natronlauge (c = 1 mol/l) zugegeben.
100 ml · Konzentration der Säure (mol / l) = 50 ml · 1 mol / l
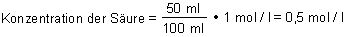
Hier ist die graphische Verdeutlichung der Titration in Versuch 2.
In unserem Webseitenangebot gibt es eine Vielzahl von Titrationsbeispielen. Bei allen muss man nur darauf achten, dass der Dreisatz richtig angesetzt wird! Das ist aber kein Problem, wenn man zuvor die Reaktionsgleichung aufstellt und dabei die stöchiometrischen Faktoren richtig wählt.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 05. Januar 2012, Dagmar Wiechoczek