

(Foto: Daggi)
Lithium-Ionen-Akkumulatoren
Laut Brockhaus* sind Lithium-Ionenzellen "Akkumulatoren hoher spezifischer Energie
(120-130 Wh/kg, bei einer Entladespannung von 4-5 V und ca. 1000 Lade- und
Entladezyklen), bei denen Lithium-Ionen im Elektrodenmaterial eingelagert vorliegen
(Interkalations-Elektroden)". Und zur Verwendung schreibt das für Schüler, Studenten
und Lehrer empfehlenswerte Naturwissenschafts- und Technik-Lexikon: "Seit 1991 in
hochwertigen, mobilen elektronischen Geräten wie Mobiltelefone, Notebooks und
Videokameras sowie als Großbatterie in Elektrofahrzeugen". Damit wird es für Schüler
interessant.
Die Lithium-Ionen-Batterien unterscheiden sich völlig von den Lithiumbatterien. Hier haben wir einen völlig neuen Typ von galvanischen Elementen vor uns: Redoxaktiv ist nur das Elektrodenmaterial. Anders als etwa beim Daniell-Element oder Volta-Element sind die Ionen des Elektrolyten nicht am Redoxprozess beteiligt. Die eine Elektrode besteht aus exotischen Verbindungen wie Li2MnO2 (Lithium-manganat(II)), Li2CoO2 (Lithium-cobaltat(II)) oder neuerdings auch LiFePO4 (Lithium-eisen(III)-phosphat), die andere aus Graphit. Zwischen den Elektroden werden über einen äußeren Leiter oder den Verbraucher (bzw. beim Laden mit dem Ladegerät) Elektronen ausgetauscht. Den positiven Ladungsausgleich durch den Elektrolyten zwischen den Elektroden besorgen Lithium-Ionen, die aber am eigentlichen Redoxprozess nicht weiter beteiligt sind.
Im Folgenden sind schematisch und stark vereinfacht die Elektrodenvorgänge anhand des Lithium-manganats skizziert.
Im entladenen Zustand ist der Aufbau des Elements:
Li2MnO2 | Li-Salz, organisches Lösemittel | Graphit
Beim Laden laufen an den Polen folgende Vorgänge ab:
Mit dem Pluspol des Ladegeräts verbunden:
Mit dem Minuspol des Ladegeräts verbunden:
(Die Lithiumatome liegen im Graphitgitter und bilden eine Interkalationsverbindung (lat. calathus, Korb). Darunter versteht man Verbindungen, bei denen die Metallatome in kristallografisch genau definierten Lücken des Kohlenstoffgitters (oder umgekehrt) eingebaut sind. Dies spielt auch bei den Einlagerungscarbiden etwa beim Stahl eine Rolle.)
Während des Ladevorgangs wandern im Elektrolyten des Elements die Lithium-Ionen vom Pluspol zum Minuspol. Bemerkenswert ist, dass sie in einem organischen Lösemittel wie Ethylen- oder Propylencarbonat gelöst vorliegen. Ersteres ist eine andere Bezeichnung für das 1,3-Dioxolan-2-on, letzteres für 4-Methyl-1,3-dioxolan-2-on.
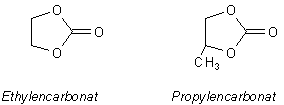
Damit sich Lithiumsalze in organischen Lösemitteln lösen, muss man sie mit unpolaren, großen komplexen Anionen wie BF4-, ClO4- oder PF6- versehen. Durch ihre Wanderung und Einlagerung stabilisieren die Lithium-Ionen die negative Aufladung des Graphits. Hierzu tragen auch die organischen, aprotischen Lösemittel bei. "Aprotisch" heißt, dass sie keine Protonen abgeben können, die dem Graphit die negative Ladung "rauben" könnten, wie zum Beispiel:
Graphit2- + 2 H+ ———> Graphit + H2
Und warum werden dann nicht die eingelagerten Lithium-Ionen entladen? Lithium hat (wie ein Blick in die Spannungsreihe der Elemente zeigt) das negativste Redoxpotential aller Elemente. Demgegenüber ist der Wasserstoff geradezu edel zu nennen!
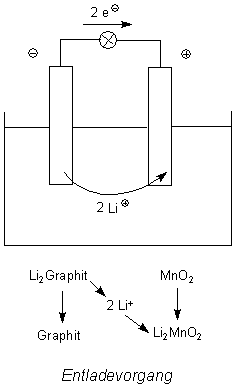
Beim Entladen laufen die umgekehrten Vorgänge ab:
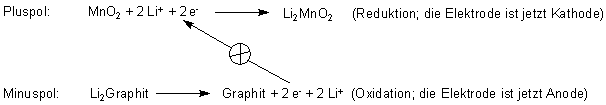
Die Lithium-Ionen wandern zurück.
Der Gesamtvorgang im Akkumulator ist:
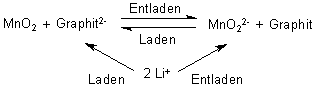
Die Lithium-Ionen wandern ("schwingen") zum Ladungsausgleich beim Laden und Entladen zwischen den Elektroden hin und her. Aus diesem Grund wird der Lithium-Ionenakkumulator auch als "Swing-Batterie" bezeichnet.
Noch eine Anmerkung zum Begriff "Spezifische Energie": Man bezieht die Energie aus praktischen Gründen auf eine Masseneinheit. Je größer der Wert ist, desto kleiner kann der Akku gebaut werden und wird so für technische Anwendung in kleinen Geräten interessant. Aber auch für den gehäuften Einsatz als Energiespender in Elektroautos ist die Lithium-Ionenzelle im Gespräch. Einsame Spitze bei ungünstigen spezifischen Energiewerten ist der Bleiakku.
Vorsicht bei Lithium-Ionen-Akkus!
Man hört es immer wieder: Diese Akkus können brennen! Das ist kein Wunder, denn sie enthalten ja leicht
entzündliche organische Lösemittel. Deren Menge kann 30 bis 70 Massenprozent betragen. Das passiert dann,
wenn die Batterien verletzt werden und Sauerstoff hinzutreten kann. Meistens geschieht das wohl beim Laden,
da sich die Akkus dabei stark erwärmen.
Deshalb sucht man nach Ersatz für die gefährlichen Lösemittel. Aussichtsreich ist der Versuch, einen Elektrolyten auf Polymerbasis herzustellen. Als Gerüst dienen silikonartige Verbindungen. Das sind zunächst anorganische Molekül-Netze aus Silicium- und Sauerstoffatomen, die organische Reste tragen. Aufgrund entsprechender Reste sind diese Polymere in der Lage, Ionen zu leiten.
Weitere Texte zum Thema „Elektrochemie“