 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1111
F: Einige Schüler von mir machen ein Projekt über das Thema Fleckentfernung.
Sie probieren "Hausmittel" im Vergleich zu kommerziellen Produkten. Bei ihrer Arbeit haben sie gelesen und
ausprobiert, dass Milch Tintenflecke entfärben soll, und tatsächlich hat das wohl besser geklappt als mit
dem Fleckenmittel.
Da Tinte ein Triphenylmethanfarbstoff ist, vermute ich, dass eine Entfärbung (analog einem Indikator wie
Phenolphthalein) stattfindet, aber mir ist unklar, welcher Bestandteil der Milch dafür verantwortlich sein soll!
Haben Sie vielleicht eine Idee?
A: Welche Tinte haben Sie untersucht?
| - | In der roten Tinte ist der Farbstoff Eosin enthalten. Das ist ein
Molekül, das im Alkalischen eine negative Ladung trägt. Im Neutralen handelt es sich letztlich um ein
Phenol. (In unserer Webseitengruppe "Farbstoffe und Färben" berichten wir darüber.)
Diese Moleküle werden von Proteinen stark adsorbiert. Grund: Da sind einmal die elektrischen Ladungen des Proteins, hier die positiven wie R-NH3+, die das Molekül festhalten. Dann kommen die Wasserstoffbrücken zu den OH-Gruppen oder anderen Sauerstoffatomen des Farbstoffs hinzu und last but not least die van der Waals-Bindungskräfte des Kohlenstoffgerüsts. Hinzu kommt, dass in der Tinte der Farbstoff die Konzentration des Farbstoffs äußerst gering ist. Die wenigen Moleküle verschwinden einfach in den Proteinmolekülen. Sie sickern quasi in die Emulsion ein. |
| - | In der blauen Tinte liegen (wie beim Kristallviolett) im allgemeinen kationische Moleküle vor. Dann gilt Ähnliches wie eben gesagt, nur dass nun die negativ geladenen Gruppen der Proteine wie R-COO- wirken. |
Ich würde aber nicht empfehlen, Proteine als Tintenkiller zu nutzen. Denn das Eiweiß wird natürlich auch vom Papier adsorbiert. Und da die Milch auch Fett enthält, gibt es sicherlich schöne Fettflecken.
1112
F: Ich muss ein Referat über Kräuter und Gewürze halten, wo ich dieses Molekül
erklären muss, welche Wirkung es chemisch und auf den menschlichen Organismus hat. Ich werde nach dem Referat
ausgefragt, und wenn ich nicht weiß, wie man dieses Molekül heißt und was diese gestrichelte Linie bedeutet,
dann wird mir da einiges an der Note abgezogen. Deswegen stell ich auch so viel Fragen, weil mich diese Fragen
auch meine Lehrerin stellen kann. Im Internet finde ich das mit dem Molekül nicht raus.
Was bedeutet die gestrichelte Linie unten zwischen dem einen H- Atom und dem H3C und dem CH2.
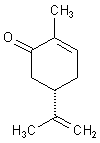
Bitte genau erklären, wie man auch diese Bindung nennt.Und wie man dieses Molekül nennt. Danke
A: Es handelt sich um (S)-(+)-Carvon. Dieses etherische Öl riecht
nach Kümmel oder Dillkraut.
Die gestrichelte Linie bedeutet, dass die Bindung bezogen auf die Zeichenebene nach hinten zeigt. Das
betreffende Ring-C-Atom hat vier verschiedene Liganden (asymmetrisches C-Atom). Die Substanz ist also optisch
aktiv. Das spiegelbildliche (R)-(-)-Carvon riecht übrigens nach Minze.
1113
F: Ich bin Lehramtsstudentin mit den Fächern Biologie und Chemie an
der Universität Kassel. Im Rahmen eines Seminars in der Biologiedidaktik wollen wir das Thema Enzymregulation
behandeln und nach Möglichkeit eine Enzymkinetik eines kompetitiv hemmbaren Enzyms aufnehmen. Ich habe den
Versuch auf Ihrer Homepage gesehen, der qualitativ die kompetitive Hemmung der Urease mit Methylharnstoff
zeigt (Indikator der Enzymaktivität Phenolphtalein). Haben Sie schon mal versucht eine Kinetik damit
aufzunehmen? Wissen Sie, ob es möglich ist, die Änderung des pH-Wertes mit der Zeit mit einer pH-Elektrode
zu erfassen (und dann die Änderung der Hydroxidionenkonzentration gegen die Zeit aufzutragen um daraus
die Anfangsgeschwindigkeit zu ermitteln)? Oder kennen Sie eine andere Möglichkeit, die genutzt werden
kann um eine Enzymkinetik aufzunehmen, die auch in der Schule einsetzbar ist?
A: Der pH-Wert ist aufgrund von Problemen mit den in der
Reaktionslösung vorhandenen komplexen und zugleich puffernden Säure/Base-Systemen nicht zu empfehlen -
höchstens zur Demonstration. Hinzu kommt, dass die Umrechnung der relativ ungenauen Messung nichts bringt.
Auch die Fotometrie hinsichtlich der Indikatorumfärbung ist ohne Erfolg, da diese verzögert eintritt und
somit der für die v/[S]-Diagramme benötigte v0-Wert nicht erhalten werden kann.
Nutzen Sie deshalb die elektrische Leitfähigkeit. Den Versuch dazu finden Sie auf meiner Homepage
beschrieben (Reaktionskinetische Analyse der Urease-Reaktion).
1114
F: Ich bin Schülerin einer 13ten Jahrgangsstufe und soll zu
dem Thema Alkaloidfarbstoffe eine Literaturarbeit schreiben. Leider finde ich zu diesem Thema kein
Material. Haben sie vielleicht ein paar Vorschläge, wo oder in welchen Büchern ich etwas dazu
finden könnte?
A: Der Begriff ist mir nicht bekannt und auch in der gängigen
chemischen Literatur nicht zu finden. Ich habe den Eindruck, dass man damit nur farbige Alkaloide beschreibt.
Bei Google taucht das Wort "Alkaloidfarbstoffe" nur an der Uni Leipzig in einer Vorlesungsinhaltsübersicht
auf. In einer anderen Quelle wird als Beispiel Berberin genannt. Mit diesem Stichwort kann ein Chemiker
etwas anfangen: Berberin, das Alkaloid der Berberitze, zählt zur Gruppe der Isochinolinalkaloide. Schon
der Struktur entnimmt man, dass es sich um einen farbigen Stoff handeln muss.
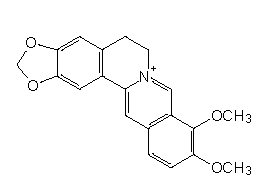
Struktur von Berberin
Berberin zum Beispiel ist die Substanz, die Berberitzenholz so intensiv gelb färbt. Folglich nimmt
man Berberin auch zum Färben von Gewebe. Da es aber nicht gesund ist, sollte man vielleicht die Finger
davon lassen. Schließlich zählt die Berberitze zu den Giftpflanzen. Dennoch wird Berberin als
Naturheilmittel genutzt und soll bakterizid, antimykotisch und auch gegen Protozoen wirken.
Bei Cholera oder Amöbenruhr soll es Wunder bewirken.
Übrigens gehört auch Morphium zu den Isochinolinalkaloiden. Man nutzt deshalb auch Berberin als
Substitut für Morphinbasen.
1115
F: Guten Tag, Prof. Blume/Team!
Ich habe zufällig gerade einen Blick in Ihre Chat groups zum Thema Silber geworfen. Deshalb folgende
Frage. Aus der Silberrückgewinnung einer Filmentwicklungsanlage sind noch 2,5 kg Silberrückstände
aufgetaucht. Früher habe ich diese regelmäßig anfallenden Rückstände an die Degussa geliefert.
Bei der nun aufgetauchten relativ kleinen Rest-Menge sind die Aufbereitungskosten wahrscheinlich
höher als der aktuelle Silberwert von ca 8,50US$/oz. Gibt es ein chemisch-technisches Verfahren,
um aus diesen Rückständen selber weitgehend reines Silber zu gewinnen, um es so wieder in den Umlauf
zu bringen? Was sonst macht man mit diesem (halb-)edlen Rohstoff? Was genau macht denn die Degussa
mit solchen Rückständen ?
A: Solch ein chemisch-technisches Verfahren gibt es nicht
für Mini-Mengen. Degussa hat ihr Verfahren sicherlich schon optimiert... Beim laienhaften Versuch, Silber
aus Fotochemikalien und anderen Rückständen zu recyclen, sind die Umweltschäden vorprogrammiert und
die Sonderabfallmengen so groß, dass Sie draufzahlen müssen. Also: Ab in den Müll mit den Filmen.
Zu Ihrer Frage "Was genau macht denn die Degussa mit solchen Rückständen?" muss ich Sie leider an
Degussa verweisen. Deren labortechnische Feinheiten sind mir nicht bekannt. Bei denen macht es vor allem
auch die Masse der anfallenden Silbermengen sowie die genau definierte Zusammensetzung der von Großlabors
der Fotochemie angelieferten Abfälle, dass sich das Degussa-Verfahren lohnt. Denn der Silberpreis ist
absolut im Keller...