 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1651
F: Zuerst danke ich Ihnen für Ihre äußerst informative Internetseite. Ich bin ein Fan Ihres
"Tipp des Monats".
Momentan behandle ich im Chemieunterricht (Klasse 13) das Thema der Kohlenhydrate. Dabei stellte ich die folgende Aufgabe:
„D-Xylose ist ein Bestandteil des Polysaccharids Xylan. In Xylan sind D-Xylopyranose-Reste Beta-(1->4)-glykosidisch miteinander verknüpft. Entscheiden Sie, ob das Disaccharid aus zwei Xylose-Einheiten oder Xylan reduzierende Zucker sind und begründen Sie ihre Entscheidung. Wie können Sie Ihre Aussage beweisen?“
Allgemein sind Oligo- und Polysaccharide, die 1,4-glykosidisch miteinander verknüpft sind, reduzierend. Das Disaccharid müsste reduzierend sein, da sich dieser in die offene Kettenform mit reduzierbarer Aldehyd-Gruppe umwandelt. Das Polysaccharid hat nur am endständigen Ring eine reduzierbare Aldehyd-Gruppe. Ist die Fehling-Probe bzw. Tollens-Probe, die zum Nachweis verwendet werden kann, also nicht positiv? Lässt sich diese Probe bei Polysacchariden, die sich nur kolloidal lösen, überhaupt durchführen?
A: Sie beschreiben das alles richtig. Xylane sind Bestandteile der Hemicellulosen und
mancher Pflanzengummen. Xylose ist deren Monomeres; es ist übrigens eine Pentose.
Zweifelsohne sind Monomere, Dimere und Polymere der Xylose reduzierende Substanzen. Ob die Ergebnisse der Proben nach Fehling oder Tollens allerdings optisch überhaupt wahrnehmbar sind, ist eine Frage der Konzentration an reduzierenden Gruppen, bezogen auf eine bestimmte Gesamteinwaage – sagen wir einmal 10 g/Liter Lösung. Die Konzentration an reduzierenden Gruppen ist bei Monomeren am höchsten, bei Disacchariden immer noch sehr hoch, bei den Polysacchariden sehr gering, so dass das Versuchsergebnis im letzteren Falle zumindest optisch nicht auffällt.
Zur Frage nach der Reaktionsfähigkeit von Kolloiden: Die Kupfer(II)- bzw. Silber-Ionen oxidieren auch bei Vorliegen kolloidaler Lösungen. Jedes der Kolloidteilchen besteht aus Tausenden von Polysaccharid-Molekülen. Einige der endständigen, reduzierenden Gruppen müssen statistisch gesehen aus der Oberfläche herausragen und so für die oxidierend wirkenden Metall-Ionen „ansprechbar“ sein.
Zu Ihrer Frage nach „Beweisen“: Bei der Pentose Xylose kann man den chemischen Nachweis der Reduzierbarkeit mit einfachen Mitteln führen, bei den Xylanen nicht. Man kann den Beweis nur argumentativ führen: Das Xylan besteht aus vielen Xylosemonomeren. Dabei ist die Bindung identisch mit der bei den Dixylanen: β-(1->4). Der in C-Atom 4 gebundene, endständige Xylose-Rest hat somit immer ein freies C-Atom in C-Atom 1 – egal ob im Disaccharid oder im Polysaccharid. Da ersteres deutlich reduzierend wirkt, muss letzteres auch reduzieren – was wir aber wegen der wenigen entstehenden Cu(I)-Ionen und Silberatome nicht sehen können!
Das Ganze gilt natürlich auch für Glucose, Maltose und Cellobiose sowie für deren Polymere Stärke und Cellulose.
1652
F: Die Reaktion von Schwefel mit Zinkpulver will mir nicht so recht gelingen. Zumindest entsteht
nicht der erhoffte Feuerball, den man auf Ihren Web-Seiten bestaunen kann. Ich
habe alles nach Anleitung durchgeführt und vermute, dass es mit dem Zinkpulver zusammenhängt.
Die besten Ergebnisse (aber leider keinen Feuerball) habe ich mit Zink-Staub (größere Oberfläche) gemacht.
Auf der Dose stand "nicht stabilisiert". Meine Fragen:
1. Was ist denn stabilisiertes Zinkpulver?
2. Kann es sein, dass das Zinkpulver an der Luft oxidiert wurde bzw. mit CO2 reagiert (zu ZnO und Zinkcarbonat) und
daher nicht mehr reagiert?
3. Muss man daher frisches Zinkpulver kaufen oder kann man älteres reduzieren?
A: Zinkstaub oder Zinkpulver – beide gehen gleich gut. Nur ist Zinkstaub viel empfindlicher gegen
– wie Sie richtig vermuten – Korrosion durch Sauerstoff, Wasser und CO2. Sie sollten darauf achten, dass die Edukte nicht
stabilisiert sind.
„Stabilisiert“ heißt in diesem Zusammenhang, dass das Zinkpulver schon entsprechend vorbehandelt ist – meistens mit Lauge. In dieser
vorkorrodierten Form ist es weniger entzündlich, also ungefährlicher zu handhaben. Leider reagiert es dann auch nicht mehr so richtig
mit Schwefel!
Nehmen Sie außerdem immer frisches Zinkpulver. Danach muss das Gefäß wieder bestens verschlossen werden. Wichtig ist, dass Sie die molaren Mengenverhältnisse einhalten!
Einmal hergestelltes Zn/S-Gemisch ist ebenfalls nicht stabil und reagiert nach einigen Tagen nicht mehr richtig.
Eine Reduktion von vergammelten Vorräten ist nicht möglich, da die Korrosion dann erst recht einsetzt.
1653
F1: Ich schreibe meine Facharbeit in Chemie über den Stoff Juglon (5-Hydroxy-1,4-naphthochinon)
und bin gerade bei seiner Funktion als Farbstoff. Leider sagen verschiedene Quellen verschiedenes aus, daher würde ich gern wissen,
was denn jetzt richtig ist. Welche Farbe hat er wirklich?
Römpps Chemie Lexikon sagt es wären gelbe bis braunrote Prismen und bei Wikipedia steht es wäre ein farbloser bis gelber,
geruchloser Feststoff. Ist er jetzt farblos bis gelb oder gelb bis braun rot? und wenn er farblos bis gelb ist warum färbt er
dann Hände oder Haare braun?
Vielen Dank schonmal im voraus!
A1: Wenn man eine frische Walnuss aus der grünen Hülle herausschält, bekommt man braune
Hautflecken. Dafür verantwortlich ist Juglon (5-Hydroxy-1,4-naphthochinon). Das ist der Farbstoff der Fruchtschale der Walnuss,
also der grünen Außenschale, die um die harte Nussschale herumliegt.

Früchte am Walnussbaum (Foto: Blume)
Der adsorbiert sich (wie alle Phenole sowie Chinone) stark an das Protein der Haut und färbt diese braun. Dazu tragen noch oxidative Vorgänge bei, die den Farbstoff stark nachdunkeln lassen (wie man auch sieht, wenn die Schale verletzt ist). Daher bilden sich die braunen Hautflecken, wenn man eine frische Walnuss aus der grünen Hülle schält, nur langsam, aber dann auch so richtig nachhaltig…
Andererseits nahm man diesen Stoff früher als Bräunungsmittel für die Haut. Wenn man das nicht richtig auftrug, sah man reichlich scheckig aus. Inzwischen nimmt man ihn nicht mehr, da er gesundheitlich nicht ganz unbedenklich ist.
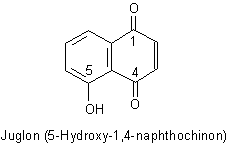
Wenn Sie sich das Molekül ansehen, erkennen Sie, dass das gar nicht farblos sein kann. Denn schon sein Molekülteil Benzochinon ist sattgelbfarben. Ein noch größerer Chromophor wie der des Juglons muss deshalb noch tiefer gefärbt sein. Das ist tatsächlich der Fall: Juglon wird als rotgelb oder braungelb beschrieben. In starker Verdünnung ist er allerdings relativ farblos. Das liegt unter anderem auch daran, dass die Farbe Gelb für uns (anders etwa als Rot) keinen Signalcharakter hat und deshalb auch in hoher Konzentration nicht auffällt.
Der Stoff ist übrigens chemisch verwandt mit dem Lawson, dem rotbraunen Farbstoff von Henna (2-Hydroxy-1,4-naphthochinon). Klicke hier.
Noch etwas: Glauben Sie nicht alles, was bei Wikipedia steht…
F2: Vielen Dank Herr Blume! Sie haben mir sehr weiter geholfen!
1654
F1: Ich bin Schüler, besuche das …-Gymnasium in …. Ich bin in der 9.Klasse und sehr an der
Chemie interessiert.
Doch nun habe ich ein kleines Problem.
In einem Chemiewettbewerb, dem Dechemax-Wettbewerb, wurde folgende Frage gestellt:
"In einem Fluss fand ein Kind eine gold-gelbe Substanz. Um zu überprüfen, ob es sich hierbei um echtes Gold handelt, ließ er es analysieren. Ein wenig Säure reichte aus, um das vermeintliche Gold aufzulösen. Dabei stank es etwas."
Nun die Frage:
1. Um welchen Stoff handelte es sich bei bei dem Fund?
2. Welches stinkende Gas entstand, als man den Feststoff auflöste?
Nach ausgiebiger Recherche glaube ich, dass es sich bei dem Feststoff um Pyrit handelt (FeS2).
Ich denke, dass das Gas Schwefelwasserstoff (H2S) sein muss, da dies sehr stinkt.
Mit meinem Chemielehrer habe ich den oben genannten Versuch durchgeführt, doch leider roch es nicht stinkend sondern eher stechend nach Chlor.
Wir versuchten eine Reaktionsgleichung zu diesem Versuch aufzustellen. Diese kriegen wir jedoch nicht ausgeglichen.
Unser Vorschlag:
FeS2 + HNO3 => Fe(NO3)3 + H2S
Entsteht bei der Reaktion vielleicht noch ein Nebenprodukt?
Über eine Antwort würde ich mich sehr freuen.
Herzlichen Dank und mit freundlichen Grüßen
A1: Ich habe zwei Anfragen zum gleichen Sachverhalt bekommen. Ihr seid wohl in einer Klasse.
Also antworte ich euch gemeinsam.
Richtig ist eure Vermutung: Es soll sich wohl um Pyrit FeS2 handeln. Als übel riechendes Gas soll wohl Schwefelwasserstoff entstehen.
Nur hat wohl derjenige, der die Frage formuliert hat, von Chemie nicht allzu viel Ahnung.
Dumm ist nämlich: Pyrit zersetzt sich nicht in allen Säuren, vor allem nicht in der klassischen „Schulsäure“, der Salzsäure. (Auf keinen Fall sagen: Es löst sich in Säure auf. Denn Lösen ist ein physikalischer und kein chemischer Vorgang.)
Wenn laut Frage die Säure nicht benannt wird, also frei wählbar ist, könnten wir ja auch Königswasser nehmen. Das ist eine Mischung aus jeweils konzentrierter Salzsäure und Salpetersäure (3 : 1). Wenn diese Säuremischung auf echtes Gold (und anderes Edles wie Platin) einwirkt, stinkt es mächtig. Es entstehen nämlich Stickoxide und vieles mehr. Dann war das „goldähnliche Stück“ tatsächlich Gold… Aber auch Pyrit wird zersetzt, und dabei stinkt es auch – wie beim Gold – aber nicht nach faulen Eiern.
Aber auch mit „harmloserer“ Salpetersäure bekommt man auch Pyrit klein. Aber das ist eine komplizierte Oxidationsreaktion, bei der statt Schwefelwasserstoff die schon erwähnten Stickoxide entstehen. Einer von Euch beiden hat über „Chlorgeruch“ berichtet: Stickoxide riechen tatsächlich wie Chlor. Das riecht ihr zum Beispiel, wenn ihr neben einem Dieselauto (Schulautobus) steht. Aus dem Pyrit-Schwefel werden dabei Schwefeldioxid (stechender Geruch) und vielleicht auch etwas –trioxid bzw. die Salze der Säuren des Schwefels, Sulfite und Sulfate.
Was Dechemax wohl als übelriechendes Gas hören möchte, ist Schwefelwasserstoff. Um das freizusetzen, muss man den Pyrit „aufschließen“. Das macht man reduktiv mit Wasserstoff „in statu nascendi“. (Zum Begriff fragt euren Lehrer!) Dazu muss man zum Pyrit(pulver) Salzsäure geben und Zink- oder Aluminiumgranalien. Nur dann entsteht Schwefelwasserstoff.
Zn + 2 HCl ———> Zn(Cl2) + H2
FeS2 + H2 + 2 H+ ———> Fe2+ + 2 H2S
Hier berichte ich darüber:
http://www.chemieunterricht.de/dc2/pyrit/pyritv03.htmProbiert es mal aus.
F2: Vielen Dank, dass sie sich die Mühe gemacht haben uns diese tolle Antwort zu schreiben.
Auch ihre Internetseite ist sehr gelungen. Ich finde es schön, dass es noch Leute gibt die sehr informative Internetseiten ,wie ihre,
kostenlos zur Verfügung stellen. Wirklich klasse!
1655
F: In der Schule behandeln wir im Moment das Thema Aromaten und dabei bin ich natürlich
auf das Pyridin, genauso wie aufs Anilin und Pyrrol, gestoßen.
Nun ist mir allerdings nicht klar, warum der Stickstoff beim Pyrrol und Anilin sein freies Elektronen Paar als +M-Effekt
dem Ring zur Verfügung stellt, aber beim Pyridin auf einmal (durch den -M-Effekt) desaktivierend auf den Ring wirkt...
Es wäre sehr nett, wenn sie mir helfen und die Frage beantworten könnten.
A: Alle drei Aromaten enthalten im Ring 6 p –Elektronen.
Diese Struktur ist besonders stabil. Die Moleküle versuchen stets, diesen energiearmen Zustand zu erreichen.
Pyrrol erreicht die 6 p –Elektronen durch Hineinschieben seines Elektronenpaars in den Ring.
Pyridin hat bereits von vornherein 6 p –Elektronen im Ring und entspricht damit dem Benzol. Ein zusätzliches Elektronenpaar würde den mesomeren Zustand stören; es entstände eine Verbindung, die nicht mehr aromatisch ist.
Anilin ist ein Benzolring, der eine Aminogruppe als Substituenten trägt. Das N-Atom stellt seine Elektronen nicht dem Ring zur Verfügung. Allerdings fördert der +I-Effekt der Aminogruppe die Mesomerie des Ringsystems (+M-Effekt).
Die Mesomerie dieser drei Verbindungen beschreiben wir auf einer besonderen Webseite: Klicke hier.