 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1921
F: Als wir neulich unsere neuen Schultaschen ausgepackt haben, hat eine Kollegin voll Entsetzen
festgestellt, dass darin die handelsüblichen Trockenbeutelchen enthalten waren. Ich war der Meinung, dass es sich dabei um Calciumchlorid
oder Silicagel handeln müsse, und damit keine gesundheitliche Gefahr davon ausgeht. Beim Untersuchen besagter Kügelchen ließen sich
diese nicht in Wasser lösen und zeigten auch keine Flammenfärbung. Ich schließe deshalb Calciumchlorid aus. Kennen Sie eine Methode,
wie ich Silicagel nachweisen könnte?
Für einen Tipp wäre ich sehr dankbar.
A: Calciumchlorid ist ätzend, stark Wasser anziehend und daher nicht in den Taschen zu finden.
Es handelt sich bei Ihren Beutelchen sicher um völlig gefahrloses und ungiftiges Silicagel (Kieselgel).
Die Analyse ist für Laien allerdings schwierig, da SiO2 bzw. Silicate völlig inert sind und es deshalb kaum einfache, spezielle Nachweisreaktionen für sie gibt. In der qualitativen Analyse kann man z. B. mit CaF2/konzentrierter Schwefelsäure stark giftige Flusssäure (HF bzw. H2F2) herstellen, die mit SiO2 und Silicaten zu SiF4 reagiert.
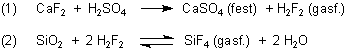
Letzteres ist ebenfalls gasförmig und ebenfalls stark giftig. Es lässt sich abdampfen. Dann reagiert es in Umkehrung der Reaktion (2) in einer Vorlage mit Wasser zu einem weißen Niederschlag von SiO2 • aq.
Man macht das Ganze mit einem geschlossenen Bleitiegel, dessen Deckel ein Loch hat, welches man mit einer schwarzen, feuchten Blattpappe abdeckt. Man erkennt dann auf dem schwarzen Untergrund einen weißen Punkt.
1922
F: Es gibt eine Pflanze, die Blutwurz heißt. Das liegt an der roten Färbung der Wurzel. Was ist
das für ein Farbstoff, denn er zeigt nicht die üblichen Färbungen der Anthocyane?
A: Hierzu haben wir eine Webseite gemacht.
1923
F: Ich bin am Düsseldorfer Flugplatz hängengeblieben, weil isländische Vulkanasche den Luftraum
verschmutzt haben soll. Ich erfuhr, dass man die Asche gar nicht sehen könne, weil nämlich nur 2 mg pro Kubikmeter Luft vorhanden seien.
Das wäre der Grenzwert, ab dem ein Flugverbot ausgesprochen werden muss. Ist das nicht übertrieben?
A: Keineswegs. Denken Sie daran, dass ein großes Triebwerk
pro Sekunde ca. 1000 Kubikmeter Luft hindurchschaufelt. Nun wird davon nicht alles zur Verbrennung des Treibstoffs verwendet,
da in den heute gebräuchlichen Mantelstromtriebwerken ein großer Teil (80-90 %) um das eigentliche Brennersystem herumgeleitet
wird. Damit gelangen etwa pro Sekunde zwar „nur“ 100 m3 (bzw. 200) • 2 mg / m3 = 200 (bzw. 400) mg Vulkanasche
in die Turbinen und Brennkammern.
Bedenkt man jedoch, dass das Flugzeug ja längere Zeit durch die Vulkanaschewolke fliegt, so kann das einen ganz ansehnlichen Haufen silicatischer Asche ergeben, die der Höllenhitze des Triebwerks ausgesetzt wird und schmilzt. Dabei bildet sich eine Art Glas, das die feinen Kühlporen der Turbinenschaufeln und anderes zusetzt. Das kann zum Aussetzen des Triebwerks führen, sogar auch zur Zerstörung.
1924
F1: Ihre Internetseiten finde ich übrigens sehr hilfreich und gut, nur leider ist "K = konst
bei Druckänderung", wie überall anders auch, nur kurz abgehandelt, aber wenig anschaulich erklärt. Das betrifft zum Beispiel die
Reaktion NO2 / N2O4. Nachdem ich aber gerade völlig verwirrt bin, kann ich leider auch keinen
hilfreichen Vorschlag liefern.
A1: Ich weiß, dass das Ganze recht verwirrend ist für Leute, die die Thermodynamik nicht
gerade als Hobby betreiben…
K ist wirklich nur von T abhängig. Ändern Sie isotherm die Konzentration eines Partners, so verschiebt sich das Gleichgewicht durch Neu- oder Rückbildung der anderen Komponente so lange, bis der für die jeweilige Temperatur gültige Wert von K wieder erreicht ist.
Zu Ihrem Beispiel: Zum Gasgleichgewicht N2O4 / 2 NO2 haben wir eine Webseite, wo wir auch den zugehörigen Versuch beschreiben.
Dass sich bei unserem Experiment wegen des geschlossenen Raums auch der Druck ändert, liegt ja daran, dass der Druck bei Gasen eine Konzentrations-Größe ist. Man spricht bei Gasmischungen übrigens von Partialdrucken. Dabei muss man beachten: Wenn man bei Gasen statt der mol/l-Konzentrationen Partialdrücke verwendet, hat die Gleichgewichtskonstante numerisch einen anderen Wert. Man unterscheidet deshalb zwischen Kc und Kp.
Mit Erhöhung der Temperatur wird die Gasmolekülzahl erhöht, der Druck steigt überproportional an. Wenn das Ganze isobar laufen würde, also ein Druckausgleich z. B. in einem verschiebbaren Kolbenprober statt in einer geschlossenen Ampulle stattfinden könnte, würde auch die Summe aller Drücke konstant bleiben.
F2: Ich habe Ihre Internetseite schon gelesen, bevor ich Ihnen das erste mal gemailt habe
und finde sie, wie gesagt, sehr gut.
Die Temperaturabhängigkeit von K kann man anhand von Teilchendarstellungen ja auch sehr schön verdeutlichen. Dass sich der Druck
dabei verändert ist auch verständlich.
Wohl aus gutem Grund haben Sie aber keine Abbildungen auf Teilchenebene, die die GGW-Verschiebung bei Druckänderung im
NOx-GGW zeigen sollen, auf Ihrer Seite abgebildet.
Meine Schlussfolgerung ist, dass man die GGW-Verschiebung durch Druckveränderung wohl besser nicht auf Teilchenebene darstellt,
da es eher verwirrend ist, als dass es zur Klarheit beiträgt.
A2: Das Problem ist, dass die Gleichgewichtskonstante letztlich doch eine unanschauliche
Größe ist. So stellen sich viele vor, dass es sich bei einer definierten Konstanten auch immer stofflich um die gleiche Mischung handeln
muss. Es ist vielmehr nur so, dass für eine bestimmte Temperatur der Quotient aus den multiplizierten Konzentrationen der am Gleichgewicht
beteiligten Stoffe immer den gleichen Wert haben muss. Das öffnet der Zusammensetzung einen weiten Spielraum. So ändern sich bei der
isothermen Druckänderung des NOx-Gasgemischs durchaus die Konzentrationen, da man ja das Volumen verändert. Dabei geht der Wert der
NO2-Konzentrationen als Quadrat ein - alles insgesamt ziemlich unübersichtlich. Deshalb haben Sie Recht: Bei Druckänderungen
sollte man auf Molekülabbildungen verzichten. Bei T-Änderungen ist das schon anders.
Und man sollte statt der Bilder mit abzuzählenden Molekülen gleich mit Konzentrationen arbeiten.
Sie fragen nach einem Beispiel, das das Ganze verdeutlichen kann. Hier ist ein schönes Beispiel aus dem Lehrbuch Charles E. Mortimer: Chemie. Das Basiswissen. Thieme-Verlag. Es geht um folgendes Gleichgewicht:
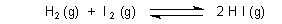
Folgende vier Versuchsansätze werden gefahren:
- Reines HI wird auf 425 °C erhitzt
- Jeweils reine H2 und I2 werden gemischt und erhitzt
- dasselbe mit H2 und HI
- dasselbe mit H2, I2 und HI
Ergebnis: Nach Einstellen der Gleichgewichte findet man in jedem der vier Töpfe (wie zu erwarten war) alle drei Spezies, aber mit jeweils unterschiedlichen Konzentrationen. Setzt man diese Konzentrationswerte in das Massenwirkungsgesetz ein, so erhält man - was viele erstaunt! - in allen vier Fällen den gleichen Wert für Kc.
1925
F: Betreff: Frage eines Referendars zum Fließgleichgewicht.
Seit meinen Tagen als Chemie-Lehramtsstudent stöbere ich immer wieder gerne auf Ihren tollen Internetseiten. Die verständlichen
Texte haben mir sicher schon manche Klausur gerettet.
Jetzt bin ich im Referendariat (LAGym,Bay) und halte demnächst eine Stunde in der Zwölften zum Thema "Temperaturabhängigkeit von
chemischen Gleichgewichtsreaktionen".
Bei der Recherche schaute ich wie so oft auf ihre Seite, da fiel mir Folgendes auf:
"Besonders interessant sind die Gleichgewichte, die bei den Abläufen in lebenden Systemen eine Rolle spielen. Anders als man allgemein meint beruhen die biochemischen Funktionen und damit das "Funktionieren" gesamter Lebewesen auf dynamischen Gleichgewichtsprozessen. Die befinden sich auf höchstem Niveau von Potential und Komplexität, das erst den für Lebewesen typischen Durchfluss von Energie, Materie und Information ermöglicht. Man spricht deshalb von einem "Fließgleichgewicht" und beschreibt damit ein extremes Ungleichgewicht aller Abläufe. Organismen im echten chemischen Gleichgewicht sind tot."
Das finde ich mal eine tolle Aussage und es wäre meiner Meinung nach auch gut als Einstieg für meine Stunde zu verwenden. "Wie siehts aus, Thomas? Fühlen Sie sich im chemischen Gleichgewicht?"
Doch leider, je länger ich über diesen Absatz nachdenke, desto unverständlicher wird er mir.
Die Antwort des Schülers kann nämlich lauten: Ja und Nein. Ja, denn Enzymreaktionen und andere Prozesse regulieren den Körper, halten ihn im chemischen Gleichgewicht. Nein, denn wenn es so wäre, wäre man tot.
Wieso bezeichnen sie das Fließgleichgewicht als extremes Ungleichgewicht? Das ist mir auch nach dem Studium ihrer Seite "Abläufe in lebenden Systemen" nicht klar.
Liegt es daran, dass der Körper als relativ geschlossenes System zu seiner Umgebung im extremen Ungleichgewicht steht?
Was wäre die korrekte Antwort auf die Frage ob man sich als Mensch bzw. Lebewesen im chemischen Gleichgewicht befindet?
A: Es ist so wie es da steht: Befindet sich ein Organismus im Gleichgewichtszustand, so ist er tot.
Wichtig als Erstes: Lösen Sie sich beim Nachdenken über Lebewesen von der Vorstellung des stabilen Endzustands einzelner chemischer (auch enzymatischer) In vitro-Reaktionen.
Lebewesen sind ständige Durchflusssysteme. Materie, Energie, Information kommen ständig in das lebende System hinein, durchfließen dieses, werden dabei verändert und verlassen es mit neuen Eigenschaften wieder. Dieses Fließen hat ein Ungleichgewicht zur Voraussetzung. Nur wenn dieses ständige Ungleichgewicht aufrechterhalten bleibt, lebt der Organismus. Im Fall des Todes wird nichts mehr aufgenommen und nichts mehr um- oder neu aufgebaut. Der endgültige Gleichgewichtszustand wird dann (wie bei jeder chemischen Reaktion) nach und nach erreicht.
Hilfreich ist auch, wenn man darauf hinweist, dass zum Fließen ständig ein Potential aufrecht erhalten bleiben muss. Eine Größe, die diesen Spannungszustand beschreibt, ist das chemische Potential oder die davon abgeleitete Gibbssche Freie Enthalpie DG. Im lebenden Organismus ist DG < 0, im Gleichgewichtszustand ist DG = 0.
Vergleichen Sie das alles mit einer gespannten Feder, die durch einen Splint gesichert ist, oder an das gefüllte, aber durch einen Schieber noch verschlossene Bergbecken eines Wasserkraftwerks. Sie werden ja wohl nicht sagen, dass sich diese in einem Gleichgewichtszustand befinden, auch wenn nach außen hin nichts passiert. Gleiches gilt für einen elektrischen Kondensator - und für Lebewesen.