 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2021
F: Ich habe in meinem studienbegleitenden Praktikum am Gymnasium Kleopatras Perlencocktail
mit einer Klasse gemacht. Leider stand ich vor dem Problem, dass sich praktisch die Muscheln in 30%iger Essigsäure erheblich besser
aufgelöst haben als in 6%igem Weißweinessig. Auch in der theoretischen Überlegung kam ich zu dem Schluss, dass ich in 30%iger Essigsäure
schließlich mehr H3O+ zur Verfügung haben müsste. Meine einzige Idee wäre, dass es mit dem Umstand einer schwachen Säure zusammenhängt,
wobei ich hier eine recht schwammige Erklärung hätte geben müssen.
Da ich diesen Versuch wohl nicht zum letzten Mal gemacht habe, und mir 3 Chemielehrer nicht wirklich weiter helfen konnten,
frag ich Sie, womit das genau zusammenhängt dass eigentlich die 6%ige besser sein sollte.
A: Zunächst einmal: Die Perlen bzw. das Perlmutt („Mutter der Perlen“) lösen sich nicht in
Säure auf, sondern sie zersetzen sich…
Zum Thema haben wir den Tipp des Monats Nr. 159.
Wie haben Sie die Reaktionsgeschwindigkeit gemessen? Entstand z. B. mit der 30%igen Säure pro Zeiteinheit mehr Gas als mit der 6%igen? Waren die Muschelschalen bei beiden Versuchen zu gleicher Größe zerkleinert?
Warum nehmen Sie zwei verschiedene Essigsorten? Es kann ja sein, dass sich im Weinessig Reste der Gärorganismen befinden, die den Versuch hemmen. Sie sollten deshalb die (technische) 30%ige Säure entsprechend verdünnen. Nur dann können Sie zweifelsfrei vergleichen.
Wenn das alles gleich (quasi genormt) abgelaufen ist, können wir weiter überlegen:
Man sollte erwarten, dass in der 30%igen Essigsäure die Protonen-Konzentration geringer ist, denn - so lernen wir - der Dissoziationsgrad
schwacher Säuren hängt bei konstanter Temperatur ja nur von der Konzentration der Säure ab. Da aber die HAc-Konzentration der 30 %-Säure
insgesamt fünfmal höher ist als bei der 6%igen, ist die Protonenkonzentration doch insgesamt wieder höher.
Erst bei viel höherer Säurekonzentration nimmt wegen der Zurückdrängung der Dissoziation die Konzentration der H3O+
so stark ab, dass die Zersetzung des Perlmutts kaum mehr stattfindet.
2022
F: Als Chemie-Lehrer trifft man in Lehrwerken immer wieder auf Unklarheiten / Ungereimtheiten, die
nirgendwo behandelt werden.
Heute habe ich zwei Fragen:
Wenn man den Schülern im Unterricht Angaben über molare Masse und Anzahl von Glucose-Einheiten in den Polymer-Molekülen Amylose, Amylopectin, Glycogen und Cellulose machen möchte, steht man vor dem Dilemma, dass man überall andere, z. T. stark voneinander abweichende Angaben findet.
Sicher hängt der "Wert", der natürlich einen großen Bereich umfassen muss, von dem betrachteten Naturstoff ab, dennoch muss ich mich für
einen entscheiden, um ihn den Schülern anzugeben, schon dass zwischen den unterschiedlichen Polysacchariden unterschieden werden kann.
Welchen Bereich/welche Werte würden Sie wählen, und gibt es irgendwo neue Angaben?
A: (Hinweis: Wegen des allgemeinen Interesses haben wir hierzu eine Webseite gemacht.
Klicke hier.)
2023
F1: Ich gehe in die 10. Klasse eines Gymnasiums und wir haben in der letzten Chemiestunde
einen Versuch gemacht, bei dem man einen geladenen Stab an einen Wasserstrahl hält und dieser durch seine polare Atombindung abgelenkt
wird. Diesen Versuch haben wir dann statt mit Wasser auch mit Petroleum gemacht. Das Petroleum hatte eine Siedetemperatur von 132-175
Grad Celsius. Wir haben angenommen, dass er sich nicht ablenken lassen würde, da die Ladungsschwerpunkte zusammen fallen, aber
unerklärlicherweise tat er es doch.
Meine Klasse und ich wären sehr froh, wenn sie uns das erklären könnten.
A1: Petroleum ist eine Fraktion bei der Erdöl-Destillation. Man nennt es auch Leuchtöl (weil
man es in Lampen füllt) oder Kerosin. Petroleum ist nun keineswegs ein reiner Kohlenwasserstoff, sondern ein Gemisch aus vielen
Kohlenstoff-Verbindungen. Darunter sind auch Substanzen wie sauerstoffhaltige Alkohole, Ether, Ester sowie Schwefel- und
Stickstoffverbindungen - und so weiter. Diese sind allesamt wie Wasser mehr oder weniger polar und reagieren entsprechend auf das
elektrische Feld des aufgeladenen Stabs.
Nehmt also statt Petroleum einen reinen, wohl definierten Kohlenwasserstoff, zum Beispiel n-Heptan oder n-Octan.
F2: Vielen Dank für die schnelle Antwort. Das erklärt es.
2024
F1: Ich hätte eine Frage zu Indigotin als Säure-Base-Indikator: Welche Reaktion zwischen
Indigotin und den Hydroxyd-Ionen läuft ab, dass der vorher blaue Lebensmittelfarbstoff seine Struktur derart ändert, dass das vorher
blaue Indigotin ab einem pH-Wert von 13 gelb wird? Die strukturelle Änderung müsste demnach das chromophore System beeinflussen.
A1: Indigotin ist Natrium-Indigodisulfonat.
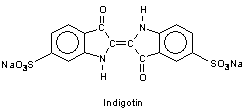
Die Sulfonat-Gruppen sind für die Farbeigenschaften unbedeutend; sie dienen nur der besseren Löslichkeit der Substanz. Indigo ist bekanntlich schwerlöslich.
Bei Zugabe von überschüssiger Lauge wirkt diese Verbindung als Indikatorsäure, gibt also (mindestens) ein Proton ab. Es handelt sich um eines der Stickstoffatome im Pyrrolidon-Ring.
Dadurch wird zwar die für das Indigo typische „gekreuzte“ Mesomerie gestört, die zu dessen intensiver Farbigkeit führt. Es lassen sich aber für das Anion weiterhin mesomere Grenzzustände herleiten. Damit kann die Farbänderung erklärt werden.
Das Anion ist schlechter anregbar, es benötigt zur Anregung also mehr Energie. Das zeigt sich schon darin, dass Indigo(tin) bereits im energieärmeren Gelb-Orange-Bereich absorbiert, während das Anion nur energiereicheres Blau absorbiert.
F2: Vielen Dank für die rasche und hilfreiche Antwort.
2025
F: Unser Sirup ist auskristallisiert. Wie bekomme ich den wieder schon geschmeidig?
A: Man kann die Zuckerkristalle durch Erwärmen des Sirups auf dem Herd beseitigen. Ob es
sich hierbei um das Schmelzen der Kristalle oder um die Steigerung der Löslichkeit des Zuckers durch Wärmezufuhr handelt, ist
letztlich egal.
Auf keinen Fall dürfen Sie den Sirup direkt auf die heiße Herdplatte stellen. Denn ungesteuertes Erhitzen führt zu Karamel und anderen Zersetzungsprodukten.
Zur Temperatursteuerung müssen Sie das Gefäß mit dem Sirup in einem Wasserbad erhitzen und im heißen Wasser stehen lassen, bis sich eine homogene Lösung ausbildet. Lassen Sie dann rasch abkühlen. Dann bilden sich keine Kristalle zurück, da Zucker relativ schwer zur Kristallisation zu bringen ist..
Das Gleiche machen Sie mit auskristallisiertem Honig.