Prof. Blumes Tipp des Monats September 2010 (Tipp-Nr. 159)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Kleopatras Perlentrunk
Vom Sinn fachübergreifender Zusammenarbeit
Das Nachrichtenmagazin DER SPIEGEL brachte in seiner Nummer 33/2010 im Wissenschaftsteil eine wahrlich atemberaubende Meldung, die wir hier nacherzählen wollen:
| Kleopatras Perlencocktail
Es geht um diese bekannte Geschichte über Kleopatra: Diese ägyptische Königin versuchte ihren römischen Lover Marc Anton mit der Story zu beeindrucken, dass sie „bei einem einzigen Mahle 10 Millionen Sesterzen“ verzehren könnte. Sie ließ sich einfach eine große, also entsprechend teure Perle in einem Glas Essig auflösen und trank das Ganze aus. Gelehrte Altertumsforscher haben diese Story bisher stets angezweifelt und ins Reich der Sagen verschoben, denn - so wurde argumentiert - Essig sei gar nicht in der Lage, eine Perle aufzulösen. Nun hat eine Archäologin von der Montclair State University in New Jersey anhand von langwierigen Laborversuchen herausgefunden, dass das doch geht. Voraussetzung sei jedoch, dass die Essiglösung nicht zu konzentriert sein dürfe, so zwischen 5 und 10 %. Am besten gehe es mit „Weißweinessig“. Zurück bleibe nur ein feiner Glibber. Die Archäologin beschreibt noch eine weitere Erkenntnis: Sie hat die Perle zu feinem Pulver zerstoßen und sie dann mit Essig übergossen. Binnen weniger Minuten war die Perle unter „kurzem Aufbrodeln“ verschwunden. |
Soweit der Bericht des Nachrichtenmagazins. Ein Chemiker kann darüber nur schmunzeln. Natürlich steckt dahinter
eine gute Portion Chemie, allerdings nur auf dem Niveau der Sekundarstufe I. Die Experimente können Schüler sogar selbst
nachvollziehen - zum Teil auch in der häuslichen Küche.
Zunächst müssen wir erklären, woraus Perlen bestehen
Es handelt sich um Perlmutt. Denn die Perle ist eine Bildung von drüsigen Organen, mit denen die
Muschel auch ihre Schale herstellt. Die Muschel ummantelt mit der Perle Sandkörner, die in ihr Inneres gelangt sind
und die sie als Fremdkörper stören.

Bild 1: Kette mit Flussperlen
(Foto: Blume)
Perlmutt ist ein biologischer Verbundstoff, der aus der Calciumcarbonat-Modifikation
Aragonit und Proteinen besteht. Typisch für Perlmutt ist seine Opaleszenz, die Perlen und abgeschliffene
und dann polierte Muschelschalen gleichermaßen zeigen. Klicke zum Beispiel hier.
Wer also keine Perle zum Zersetzen („Auflösen“) oder zum Zerreiben („Verpulvern“) übrig hat, kann auch mit einem Stück Muschelschale experimentieren. Ein Schneckenhaus täte es übrigens auch. Und wem keine Weichtierschale zur Verfügung steht, der kann auch ein Stück Kalkstein oder Kalkspat nehmen...
|
Experiment 1: Zersetzen von Perlmutt
|
Wir können natürlich auch eine Perlenkette kurzfristig (aber höchstens 1-2 Minuten lang!) in die Lösungen halten. Die Perlen nehmen dabei keinen sichtbaren Schaden - wenn man nicht vergisst, sie herauszunehmen... Bei diesem Versuch erkennt man allerdings keine Eiweißreste. Aber wir haben damit wenigstens bewiesen, dass die Story über Kleopatras Luxusmahl stimmen kann!
Klick mich an!
Bild 2: Christels Perlenkette in Haushaltsessig
(Foto: Blume)
Wie ist das Ergebnis zu erklären?
Zunächst ein Hinweis:
Es handelt sich bei der Zersetzung der Perle nicht etwa um ein Beispiel für Säure-Korrosionen. Denn
Korrosionsprozesse sind Elektronenübertragungsreaktionen. Bei der Zersetzung der
Perle handelt es sich um eine Protonenübertragungsreaktion.
Zur Beschreibung des chemischen Vorgangs der Zersetzung von Calciumcarbonat durch Essigsäure findet man oft die folgende Gleichung.
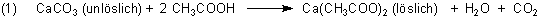
Die Gleichung ist nicht ganz richtig. Denn zur Reaktion sind freie Protonen (bzw. Hydronium-Ionen
H3O+) notwendig. Die Neutralmoleküle der Essigsäure setzen jedoch keine Protonen frei - es
sei denn, es ist eine Base anwesend. Solch eine Base ist Wasser.
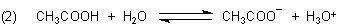
Gleichung (2) beschreibt ein Säure/Base-Gleichgewicht oder eine Brönsted-Säure/Base-Reaktion.
Dieses Gleichgewicht ist von der Konzentration der Base Wasser abhängig: Je größer der Anteil von Wasser ist, desto mehr
liegt die Essigsäure in dissoziierter Form vor und bildet umso mehr Hydronium-Ionen H3O+, die
mit dem Kalk reagieren können. (Das geht in der Praxis natürlich nicht bis zur unendlichen Verdünnung, denn irgendwann
gehen die Protonen wegen fehlender Essigsäuremoleküle aus...)
Haushaltsessig ist übrigens eine fünfprozentige, Essigessenz im Allgemeinen eine dreißigprozentige Lösung von Essigsäure.
Nun können wir die richtige Zersetzungsgleichung schreiben:
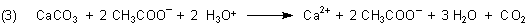
Im Allgemeinen lässt man zur Vereinfachung der Gleichung die am Reaktionsgeschehen nicht weiter beteiligten
Acetat-Ionen weg:
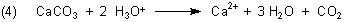
Welchen Einfluss hat die Zerkleinerung der Perle auf die
Zersetzung?
Auch hierzu machen wir erst einmal das zugehörige Experiment:
|
Experiment 2: Zersetzung von zerkleinertem Perlmutt
|
Die Erklärung: Das Zersetzen der Perle ist ein Vorgang, der an der Grenzfläche zwischen einer Flüssigkeit und einem Festkörper abläuft. Je feiner das Perlmutt zerteilt ist, desto größer ist die Oberfläche. (Hier rechnen wir so etwas einmal vor.) Die Zerkleinerung der Perle erhöht also ihre Zersetzungsgeschwindigkeit.
Fazit:
Hätten die Altertumsforscher und Archäologen in der Schule im Chemieunterricht besser aufgepasst oder gleich einen
Chemiker gefragt, hätten sie sich hinsichtlich Kleopatras sagenhaftem Perlentrunk viele Spekulationen („Gibt’s nicht!“)
oder schweißtreibende chemische Forschungsarbeit im Labor ersparen können.
Schon in meiner Schulzeit gab es den folgenden Schnack:
| “Wie können Sie unterscheiden, ob eine Kette aus echten oder aus falschen Perlen besteht? - Legen Sie die Perlenkette eine Nacht in Essig. Wenn Sie am nächsten Morgen nur einen Faden finden, waren die Perlen echt.“ |
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 30. August 2010, Dagmar Wiechoczek
