Prof. Blumes Tipp des Monats November 2007 (Tipp-Nr. 125)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Bild 1: Verlassene Weinbergschneckenhäuser
(Foto: Blume)
Chemie rund um die Schnecke
Jetzt wird es wieder Winter, das Laub verschwindet. Dann liegen sie da herum, die vielen verlassenen Schneckenhäuser. Die Weinbergschnecken (Helix pomatia), die ich hier vorstelle, haben wir im Gebiet um Urach gefunden. Die Weinbergschnecken sind absolut geschützte Tiere. Theoretisch darf man nicht einmal ihre hübschen Häuschen aufsammeln und mitnehmen.
Warum soll man nicht mal versuchen, mit diesem Thema einen Chemieunterricht zu gestalten? Vielleicht bleibt thematisch auch noch etwas für´s kommende Jahr über, denn auch die lebende Schnecke gibt (im wahrsten Sinne des Wortes) genügend Stoff zum Experimentieren. Das wird dann ein fächerübergreifender Unterricht im besten Sinne. Heute aber geht es uns in erster Linie um chemische Experimente. Hier stellen wir einmal einen kleinen Themenkatalog zusammen.
Zuvor: Woher stammt der wissenschaftliche Name der Weinbergschnecke?
Der Name ist Helix pomatia.
Helice ist das lateinische Wort für „Schneckenspirale“. (In diesem Zusammenhang sei auf Folgendes
hingewiesen: Die Weinbergschnecke gehört zu den Schnirkelschnecken. Schnirkel bedeutet soviel wie Schnörkel.)
Pomatia ist abgeleitet von einem anderen lateinischen Wort, pomarium. Das bedeutet
„Obstgarten“. Der war immer schon identisch mit dem Weinberg. (Auch heute pflanzen Weinbauern in vielen
Gegenden zwischen ihren Weinreben normales Obst an.)
Übersetzt heißt die Schnecke somit „Die Schneckenspirale aus dem Obstgarten bzw. Weinberg“. Der
Name stammt übrigens von Linné selbst.
Jede Schnecke ist ein Schleimer
Schleimsubstanzen enthalten meistens Polysaccharide und Proteine sowie
Verbindungen von beiden, die als Poly-Ionen viele elektrische Ladungen tragen. Daher sind sie
in der Lage, viel Wasser zu binden. Das kennen wir von den Gelbildnern.
Zum Nachweis der Polysaccharide müssen wir diese zunächst hydrolysieren. Dabei entstehen einfache,
reduzierende Zucker. Dann greifen wir auf die bekannte Fehlingsche Probe zurück. Proteine weisen
wir mit der Biuretprobe nach.
Nun könnten wir (leider nur im Sommer…) versuchen, Schnecken über einen Parcours zu jagen, um ihnen etwas Schleim abzuluchsen. Aber das ist sehr, sehr wenig, was sie absondern. Und wenn das Wasser verdunstet ist, sieht man höchstens einen dünnen Film. Außerdem versuchen die Schnecken, immer den gleichen Weg zu nehmen. Dabei fressen sie ihren Schleim oder den anderer Schnecken gleich wieder auf – also ein echtes Recycling.
Wir können die Schnecke aber auch mit einem Grashalm in der Nähe ihres Atemlochs „kitzeln“. Dann schäumt sie kräftig los. Das Schäumen gehört zu ihren Abwehrmaßnahmen gegen (vermeintliche) Feinde.

Bild 2: Schleimende Schnecke
(Foto: Blume)
Man kann natürlich auch den Schleim einsammeln, der von den Schnecken abgesondert wird, die gerade
an Schneckenkorn genascht haben. Sie als Lehrperson sollten aber keinesfalls
Schnecken vor der Klasse mit Schneckenkorn füttern…
|
Versuch 1: Untersuchung von Schneckenschleim
Eine ausreichende Menge an Schneckenschleim wird in einem kleinen Becherglas mit Siedesteinchen oder in einem Erlenmeyerkolben einige Minuten mit nicht zuviel konzentrierter Salzsäure (C) erhitzt. Man lässt abkühlen und neutralisiert die Mischung mit Natronlauge (C) (Vorsicht!). Wir teilen die Flüssigkeit und bewahren eine Hälfte für den zweiten Versuch auf. 1. Fehlingsche Lösungen werden gemischt und zum
Hydrolysat gegeben. Wir erhitzen in einem Wasserbad.
2. Die andere Hälfte neutralisieren wir und versetzen mit Biuret-Lösung.
|
Das Schneckenhaus – ein Wunderwerk nicht nur aus Kalk gebaut
Schneckenhäuser sind bemerkenswerte Bauwerke. Sie sind nicht nur hübsch anzuschauen, sondern auch von höchster
Stabilität. Gebaut hat die Schnecke die sicher nicht, um uns damit zu erfreuen. Sie dienen als Schutzschild gegen Feinde
und Unfälle, z. B. Sturz oder Stoß.
Woraus besteht ein Schneckenhaus? Wie können wir das Schneckenhaus analysieren? Zunächst müssen wir es „auflösen“,
also zersetzen. Dazu benötigen wir eine Säure.

Bild 3: Schneckenhaus in Säure
(Foto: Blume)
|
Versuch 2: Zersetzen eines Schneckenhauses durch Säure
|
Bemerkenswert ist, wie das Schneckenhaus während des Zersetzungsprozesses immer wieder aufschwimmt. Der Grund ist, dass sich auch in dem Häuschen Gas bildet.
Um herauszufinden, woraus das Schneckenhaus besteht, müssen wir noch einige Nachweise führen.
|
Versuch 3: Nachweis einzelner Substanzen, aus denen das Schneckenhaus besteht 1. Analyse des Gases
Ca(OH)2 + CO2 ———> CaCO3 + H2O 2. Calcium-Ionen
Ca2+ + 2 OH- ———> Ca(OH)2 Calcium-Ionen kann man auch nachweisen, indem man zur filtrierten, schwach sauren Lösung eine Lösung von Oxalsäure
(Xn) oder Ammoniumoxalat (Xn) zugibt.
Ca2+ + (COOH)2 ———> (COO)2Ca + 2 H+ 3. Proteine
4. Kohlenhydrate
|
Das Schneckenhaus ist hypermodern konstruiert
Wir haben also gesehen, aus welchen Stoffen das Schneckenhaus besteht: aus Calciumcarbonat, Proteinen und Polysacchariden.
Es handelt sich um eine ungewöhnliche Mischung von anorganischem und organischem Material. Wie ist das
zusammengefügt?
Hinter dem Bau des Schneckenhauses steckt ein wichtiges Prinzip, das der Biomineralisation.
Darunter versteht man die Fähigkeit lebender Organismen, Mineralien zu bilden.
Die Mineralien sind in einer Matrix von Proteinen sowie Polysacchariden eingebettet. Dabei werden die amorphen Makromolekülnetze zuerst gebaut; sie dienen als Vorlagen („Templates“), in die dann die von speziellen Zellen ausgeschiedenen, winzigen Mineralienkristalle nach einem exakten Schema und mit exakter räumlicher Ausrichtung eingebettet werden. Merkwürdigerweise beginnt auch die Bildung von Calciumcarbonatkristallen mit Clustern, die zunächst amorph sind und erst ab einer gewissen Größe kristallin werden. Durch Einflüsse der Umgebung entscheidet sich, wie es weiter geht: Im Schneckenhaus (und Muschelschalen) finden wir nur wenige Mikrometer große, sechseckige Tafeln aus der Calciumcarbonatmodifikation Aragonit, die - wenn man so will - durch einen makromolekularen Klebstoff miteinander verbunden sind. Das alles wird nach einem genetisch vorgegebenen Bauplan gesteuert. Bei den Seeigeln und den anderen Stachelhäutern bildet sich von vornherein der wesentlich stabilere Calcit.
Techniker sagen: Die winzigen Mineralkristalle bilden zusammen mit den organischen Makromolekülen Komposite (Verbundstoffe), die ganz andere Eigenschaften haben als die einzelnen Komponenten, aus denen sie entstanden sind. So sind Kalk und die makromolekulare Matrix jeweils für sich brüchig bzw. „quallig“. Zusammen aber sind sie unschlagbar. Sie sind so widerstandsfähig, dass man sogar darüber nachdenkt, dieses Bauprinzip zur Konstruktion von schusssicheren Westen zu verwenden. Hier treffen sich in idealer Weise moderne Werkstoffentwicklung und Nanotechnologie.
Die Bruchstabilität der Molluskenschalen beruht darauf, dass feine Risse in der Aragonitschicht durch die folgende Proteinschicht ausgebremst werden. Das erinnert an das schusssichere Glas der Bankschalterfenster.
Die regelmäßige Schichtstruktur mit dem Proteinkleber zwischen den Aragonitplättchen sorgt nicht nur für hohe Festigkeit der Schalen, sondern auch für den bekannten bunten Perlmuttglanz. Denn die Plättchen sind nur wenige 100 nm dick – das entspricht dem Wellenlängenbereich des sichtbaren Lichts. Deshalb wird das Licht wie an Tausenden von Prismen gebrochen und dazu noch am organischen Material reflektiert.
Die Natur hat das, woran die Menschen intensiv forschen, schon lange erfunden. Jeder kennt die Zähne, Knochen, Perlen, Muschelschalen und nun auch die Schneckenhäuser. Ein anderer, allerdings nichtmineralischer Verbundstoff ist das Holz. Solche Verbundstoffe nennt man „naturoptimiert“.
Dieses Nachahmen der Natur durch die menschliche Technik hat man sogar mit einem besonderen Fachausdruck beschrieben: Biomimetik.
Schnecken sind aber auch noch in anderer Hinsicht modern.
Schnecken sind Umweltaktivisten
Sie sind nicht nur Vertilger allerlei Unrats, wozu auch Hundekot gehört. Letzteres sollten die Leute wissen,
die gerne Schnecken essen…
Darüber hinaus speichern sie beim Bau ihrer Häuschen das Treibhausgas CO2. Ein Schneckenhaus wiegt etwa
4,5 g, mit Deckelchen 5 g. Die Schüler sollten einmal ermitteln, wie viel CO2 durch eine bestimmte Menge an
Schneckenhäusern fixiert wird! Dabei können sie auch herausbekommen, wie viel Prozent der Schale aus Kalk besteht.
|
Versuch 4: Wie viel CO2 ist in einem Schneckenhaus enthalten?
Statt Wasser geben wir aber stark verdünnte Salzsäure hinein, um zu verhindern, dass von der Sperrflüssigkeit CO2 absorbiert wird. Wir geben die Kalkschalenstücke in eine Vorrichtung zur Gasentwicklung. Als Säure füllen wir Salzsäure (c = 2 mol/l)
(C) ins Vorratsgefäß. Wir schließen die beiden Apparaturen zusammen und tropfen die Säure zu.
|
Die große Zahl verwundert kaum, denn schließlich bestehen ca. 90-95 % der Schale aus Kalk. Hier rechnen wir das vor.
Zum Ergebnis: Die Rechnung ergibt, dass die Hälfte der Masse eines Schneckenhauses aus CO2 besteht. Ordnen wir das einmal in unsere aktuelle Umweltdiskussion ein:
Ein Mensch atmet ernährungsbedingt pro Tag etwa 1 Kilogramm CO2 aus. Das sind 550 Liter des Gases.
Um das aufzufangen, müssen schon eine Menge Schnecken Häuser bauen. Also schützen wir die schleimigen Häuslebauer! Denn was passiert mit den Schalen im besten Fall? Sie werden zu Fossilien, das heißt, sie werden im Boden eingelagert, der sich z. B. mit Tuffkalk weiterhin zu Kalksedimenten verfestigt. Hier ein paar Beispiele aus dem Quartär. Die Fossilien sind etwa 1 Millionen Jahre alt.


Bild 4: Schnecken aus dem Pleistozän (Diluvium)
(Fundort: Riedlingen an der Donau; Fotos: Blume)
Weitere Themen rund um die Schnecke
Es gibt noch viele weitere Anknüpfungspunkte, die das Tier neben seinen biologischen Schwerpunkten auch für andere
naturwissenschaftliche Bereiche interessant machen.

Bild 5: Weinbergschnecke (Helix pomatia) am Uracher Wasserfall
(Foto: Blume)
1. Die Suche nach dem „Linkser“
Je nachdem, wie das Gehäuse von Schnecken gewunden ist, sprechen wir von Linksern und Rechtsern. Wenn Sie in Ihrem Garten oder beim
nächsten Spaziergang in der freien Natur auf eine Gehäuseschnecke treffen, schauen Sie sich diese deshalb einmal genauer an.
Um die Wachstumsrichtung richtig zu beurteilen, halten Sie die Schnecke so, dass Sie auf die Spitze schauen. Dann legen Sie
fest, in welche Richtung die Mündung wächst: Mit (rechts) oder gegen den Uhrzeigersinn (links). Aber erwarten Sie nicht
zuviel: Von etwa 20.000 Weinbergschnecken trägt nur eine ihr Schneckenhaus in Form einer linksgängigen Spirale auf dem
Rücken. Den Träger eines solchen Häuschens nennt man deshalb auch „Schneckenkönig“.
 |
 |
| Bild 6: Rechtser und Linkser bei Weinbergschnecken
(Fotos: Andreas) |
Solche Rechts/Links-Phänomene gibt es auch in der Chemie, die sich vor allem mit Strukturfragen befasst.
Es existieren nämlich Moleküle, deren Formen sich wie Bild und Spiegelbild verhalten. Dazu haben wir
Webseiten.
Manche Moleküle kommen aber nur in einer Form vor. Hier sei vor allem auch an die Linksspirale der DNA erinnert. Um es gleich zu sagen: Auch die „Linkser“ unter den Schnecken verfügen nur über eine normale, linksgewundene DNA. Man spricht auch hier von einer "Helix".
Und auch mit dem Aufbau von Proteinen aus „falschen“ Aminosäuren hat das Phänomen des Schneckenkönigs nichts zu tun. Das ist so wie bei den Seeigeln, bei denen man üblicherweise nur Schalen mit einer Fünfersymmetrie findet. Es gibt aber auch Abweichungen.
2. Farben aus dem Meer
Einige Schnecken enthalten Farbstoffe oder zumindest Vorstufen von ihnen. Purpur
ist der bekannteste aus Schnecken herstellbare Farbstoff. Chemisch handelt es sich um Dibromindigo.
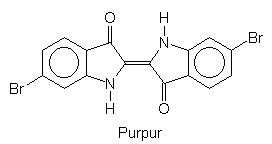
(Hierzu haben wir eine Webseite.) Purpur können wir im Unterricht nicht herstellen, aber Indigo. Damit können wir zeigen, wie das Färben mit solchen „Küpenfarbstoffen“ funktioniert. Lies hier.
3. Wie Schnecken ihr Haus winterfest machen
Wenn es kalt wird (aber auch, wenn es im Sommer zu heiß und trocken wird) verschließen die Schnecken ihr Häuschen
mit einem dicken Deckel aus dem gleichen Komposit wie das Schneckenhaus. Der Deckel ist aber, weil es so rasch gebaut werden muss,
nicht so fest, wirkt deshalb auch irgendwie etwas mürber. Aus diesem Grunde ist es wohl auch dicker als die normale Schale.
Diese nierenförmigen Deckelchen, die die Häuslebauer in normalen Zeiten wieder abwerfen, sieht man auch herumliegen, wenn
man genau hinschaut.

Bild 7: Schneckenhausdeckel
(Foto: Blume)
Außerdem graben sich die Schnecken ein. Dass sie richtig buddeln können, sieht man auch, wenn sie z. B. ihre Eier
vergraben. Siehe das folgende Bild.

Bild 8: Eine Bänderschnecke legt Eier in ein von ihr gegrabenes Erdloch
(Foto: Blume)
4. Last but not least: Die Chemie des Schneckenkorns
Dazu haben wir einen Tipp des Monats. Hier zeigen wir nur die Strukturformel des Gifts.
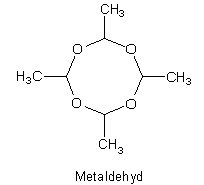
Schade eigentlich, dass man mit einer Substanz, die eine so schöne Struktur aufweist, die Erbauer der so schön strukturierten Schneckenhäuser umbringt…
Zum Tipp gibt es Vortragsfolien; klicke hier.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 09. Juli 2012, Dagmar Wiechoczek