 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2051
F: Ich habe auf Ihren großartigen Seiten schon viel gelernt und mir dadurch auch viele Fragen
selbst beantworten können.
Eine Sache geht mir allerdings im Kopf herum, ohne dass ich eine befriedigende Erklärung gefunden hätte. Ich habe letztens im
Unterricht Paraffinöl (farblos) mit Perlkatalysator gecrackt und u.a. das flüssige Produkt der Reaktion in einer Kühlfalle aufgefangen.
Ich dachte zunächst, dass sich evtl. Pigmente aus dem orangen Gummischlauch gelöst haben könnten, aber auf einem Youtubefilm, den ich
anschließend betrachtet habe, wurde die Reaktion in einer reinen Glasapparatur durchgeführt und auch dort entstand ein gelbliches Kondensat.
Eine Erklärung zur Farbigkeit habe ich nirgends gefunden.
Der Rest des Paraffinöls, der im Reagenzglas nach Abbruch des Versuches zurückblieb, färbte sich sogar gelb-grünlich. Ich hatte
ursprünglich mit farblosen Alkenen als Reaktionsprodukt gerechnet. Haben Sie eine Idee?
A: Alle Crack-Reaktionen laufen radikalisch ab. Bei diesem Versuch entsteht neben den
abdestillierenden Crackprodukten deshalb allerlei organisch-chemischer Müll. Hinzu kommt, dass Sie nicht unter Ausschluss von Sauerstoff
arbeiten.
Dadurch kommt es zur Bildung von ungesättigten Ketonen und dazu noch von Aromaten, die u. a. auch Chinone und chinoide Verbindungen bilden. Das alles ist gelb gefärbt. Es können sich auch grünliche Phenylmethanfarbstoffe bilden. Weiterhin kann es zu Polymerisationen kommen, wobei rötliche bis braune Produkte entstehen. Ich erinnere an die Struktur des schwarzbraunen Lignins.
Außerdem können auch Radikale in die Destillationsvorlage gelangen und dort entsprechende Farbreaktionen auslösen.
In der Technik hat man ganz andere Möglichkeiten und erhält deswegen entsprechende Produkte. Ich meine, Sie sollten die Aufmerksamkeit der Schüler nicht auf die augenscheinliche Qualität des Produkts lenken, sondern darauf, dass es prinzipiell geht, durch Cracken aus langkettigen Paraffinen ungesättigte Verbindungen zu erzeugen.
2052
F: Ich habe da ein Problem bezüglich der Benennung eines ringförmigen Alkens (siehe Strukturformel),
bei dem die Doppelbindung nicht im Ring liegt. Da die Doppelbindung eine höhere Priorität hat, müsste sie ein Teil der Stammkette sein,
aber wie benennt man dann den Rest?
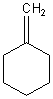
A: Die Verbindung heißt Methylencyclohexan.
2053
F1: Ich hätte mal wieder eine kurze Anfrage.
Für die Polykondensation wird die Reaktion zwischen Bernsteinsäure und Glycerin als Schülerversuch in vielen Lehrwerken vorgeschlagen.
Bei Verwendung der angegebenen Versuchsanleitungen war es sowohl bei mir als auch bei meinen Kollegen immer so, dass ein "vernünftiger"
Kunststoff nicht herzustellen war (nur Braunfärbung, kein einheitliches Produkt).
Vielleicht liegt es daran, dass es uns in der Schule nicht gelingt, beim Erwärmen die Temperatur unter einem bestimmten Level zu
halten und/oder die Reaktionszeit länger ist als in den Versuchsanleitungen angegeben? Oder ist dieser Versuch prinzipiell als Versuch
an der Schule ungeeignet? Oder kennen Sie einen besonderen "Trick"?
Für eine - auch kurze Antwort - wäre ich sehr dankbar.
A1: Bei diesen Versuchen sind farblose und dazu noch klare Produkte nicht zu erwarten. Das liegt
einerseits (wie Sie richtig vermuten) an der schlechten Temperatursteuerung und andererseits daran, dass die empfindlichen Substanzen die
Tendenz haben, in der Hitze radikalisch zu zerfallen und dabei braunen organisch-chemischen Müll zu erzeugen. In der Technik hat man ganz
andere Möglichkeiten und erhält deswegen entsprechende Produkte.
Ich meine, Sie sollten die Aufmerksamkeit der Schüler nicht auf die augenscheinliche Qualität des Produkts lenken, sondern darauf, dass es prinzipiell geht, auf diese Weise Polymerisate zu erzeugen.
F2: Vielen Dank für Ihre erhellende Antwort.
2054
F: Bei mir wurde ein Belastungs-MRT gemacht. Welche Rolle spielt dabei Adenosin?
Weshalb verabreicht man zusätzlich Kontrastmittel?
A: Genau genommen handelt es sich um ein Stress-Cardio-MRT. Man führt
es gern anstelle einer Herzkatheter-Untersuchung durch, weil es schonender ist.
In der engen MRT-Röhre kann man körperliche Stresssymptome nicht durch anstrengende Tätigkeiten hervorrufen. Man muss deshalb medikamentös nachhelfen. Aus biochemischen Forschungen ist bekannt, dass man durch die Gabe von Adenosin körperliche Belastung simulieren kann. Diese Verbindung ist die Vorstufe des als Energiewährung der Zellen bekannten AMP/ADP/ATP-Systems.
Die große Konzentration von Adenosin täuscht vor, dass relativ dazu zu wenig ATP vorhanden ist, und kurbelt auf diese Weise den Energie-Stoffwechsel an. Unter anderem koppelt Adenosin mit bestimmten Rezeptoren und wirkt dadurch auch noch gefäßerweiternd (vasodilatorisch). Folglich kommt es zur Beschleunigung des Kreislaufs. Während der Gabe von Adenosin fühlt man sich tatsächlich wie unter einer starken körperlichen Belastung. Bemerkenswert sind starkes Herzklopfen, Beschleunigung der Atmung und Hitzegefühl. Das Ganze klingt aber bereits innerhalb weniger Sekunden ab, weil das Adenosin äußerst rasch zu ADP bzw. zu ATP phosphoryliert wird. Aus diesem Grunde muss während einer länger dauernden Untersuchung Adenosin kontinuierlich zugeführt werden.
Weshalb verabreicht man zusätzlich Kontrastmittel? Dies dient zur Verbesserung der MRT-Abbildungen. Bei den Substanzen handelt es sich um Verbindungen des Gadoliniums wie Gd-DTPA. Hinter der Abkürzung DTPA verbirgt sich der Chelatbildner Di-ethylen-triamin-pentaessigsäure bzw. ihr Natriumsalz (A steht für acetic acid bzw. acetate). DTPA ist chemisch verwandt mit dem EDTA (Ethylen-diamin-tetraessigsäure). Für weitere Informationen zur Kontrast-Verstärkung klicke hier.
2055
F: Ich stehe vor einem Rätsel oder vielleicht auch nur auf dem Schlauch, denn ich komme immer
wieder auf das gleiche (falsche?) Ergebnis.
Es geht um folgende Aufgabe: Der pH-Wert einer Mischung zweier Salzsäurelösungen (je ein Liter mit pH = 3 bzw. pH = 4) soll berechnet werden, ebenso die Hydroxid-Ionen-Konzentration aller drei Lösungen.
Meine Überlegung ist folgende:
Mischt man je einen Liter zweier Salzsäurelösungen miteinander, so kann man den neuen pH-Wert errechnen, indem man zunächst die neue
Konzentration der H3O+-Ionen und dann den negativ dekadischen Logarithmus dieser Konzentration bestimmt.
Die neue Konzentration wiederum wird bestimmt, indem die Stoffmengen der H3O+-Ionen der beiden Ausgangslösungen
addiert und durch das neue Volumen (2L) geteilt werden, also hier c(neu) = 0,00055 mol/l, d.h. pH = 3,26.
Bestimmt man auf die gleiche Art die Konzentration der Hydroxid-Ionen in den beiden Ausgangslösungen und ebenfalls die Konzentration der Hydroxid-Ionen in der Mischung, so ergibt sich Folgendes:
pH = 3 –> c(OH-) = 10-11 mol/l
pH = 4 –> c(OH-) = 10-10 mol/l
c(neu) = 5,5 x 10-11 mol/l
ABER:
Berechnet man dann von der neuen Lösung das Ionenprodukt der Oxonium-Ionen und der Hydroxid-Ionen, so ergibt sich 5,5 x 10-11 mol/l x 0,00055mol/l = 3,025 x 10-14 mol2/l2 und nicht, wie normalerweise zu erwarten, 10-14 mol2/l2.
Dieser Zusammenhang leuchtet mir chemisch nicht ein. Es wäre nett, wenn Sie mir entweder meinen Denkfehler aufzeigen oder mir erklären könnten, warum das Ionenprodukt in der neuen Lösung nicht 10-14 ergibt.
A: Wegen des allgemeinen Interesses haben wir hierzu eine Webseite gemacht. Klicken Sie
hier.