 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2071
F: Ich bin ein leidenschaftlicher Mineraliensammler und habe mich in den letzten Jahren sehr häufig
mit den Erzmineralien des Rauriser Tales beschäftigt.
Auf den z. T. noch aus dem Mittelalter stammenden Halden sind u. a. schöne Arsenkiesstufen zu finden.
Meine Frage: Ist dieses Mineral giftig (z.B. schon beim Berühren oder beim Reinigen z. B. mit Salzsäure (um den vom Pyrit stammenden
Limonit zu entfernen))?
Ist ein Aufbewahrung im Glasschrank problematisch - ich habe gelesen, es könne sich langsam Arsentrioxid (Arsenik) bilden.
Grundsätzlich bin ich da schon vorsichtig (Hände waschen etc.)
A: Arsenkies ist wie alle Arsenmineralien giftig und sollte auch nicht mit Säuren oder Laugen
behandelt werden. Es bildet sich tatsächlich Arsenik. Hierzu haben wir einen Tipp des Monats.
2072
F: Zu Beginn möchte ich Ihnen und Ihrem Team danken, dass Sie den Bildungsserver betreiben, er hat mir
bereits des Öfteren bei weitergehenden Recherchen zum Unterrichtsstoff geholfen.
Ich bin zurzeit in der 12. Klasse der Fachoberschule (Marktheidenfeld, Bayern) und schreibe eine Seminararbeit zum Thema "Gleichgewichtsreaktion
in der Chemie am Beispiel der Ammoniaksynthese".
Ich bin gerade dabei die Grundzüge der Gleichgewichtsreaktion darzustellen und möchte eine Angabe zur Enthalpie machen, da diese im späteren
Verlauf eine wichtige Rolle spielen wird (Prinzip von Le Chatelier und technische Umsetzung mit einem geeigneten Katalysator).
Ich finde leider sehr unterschiedliche Schreibweisen zur Enthalpieänderung dieser Synthese, inwiefern unterscheiden sich die Angaben und welche ist die aktuell verwendete?
1. ΔH = -92,3kJ (Ihre Internetseite: http://www.chemieunterricht.de/dc2/katalyse/k-nh3.htm)
2. ΔHm = -92KJ/mol (Unterrichtsbuch Chemie Fachoberschule Technik vom Bildungsverlag Eins-Stam 2. Auflage)
3. ΔH° = -92kJ/mol (Buch: Allgemeine und Anorganische Chemie von Erwin Riedel 6. Auflage)
4. ΔRH° = -92kJ/mol (Duden Chemie Abitur: Basiswissen Schule)
5. ΔRH = -92kJ/mol (Unterrichtsbuch Chemie für Berufsfachschulen und Fachoberschulen Bildungsverlag Eins 4.Auflage)
Ich hoffe Sie können mir mit meiner Frage weiterhelfen.
A: Gleich vorneweg: Einige Werte sind unterschiedlich, wenn man „normale“ Anwendungsbeispiele wählt.
Das Komplizierte ist bei Ihrem Beispiel Ammoniaksynthese, dass sich aufgrund der Synthese aus den Elementen die Werte nicht unterscheiden.
ΔH ohne weiteren Index beschreibt nur die Änderung der Reaktionsenthalpie für den gesamten Formelumsatz (wie bei uns beschrieben).
ΔHm bezieht sich auf molare Umsätze. Ist aber ohne Angabe, auf wessen Mol bezogen ist, eigentlich ohne Wert. Hier geht es offensichtlich um ein Mol Stickstoff.
ΔH°: Der Hochindex ° steht stets für eine Standardgröße, hier also Standardenthalpie (bezogen auf molare Mengen bei 25 °C).
ΔRH bzw. ΔRH°: Der Index R steht für „Reaktion“. Entspricht der Angabe für den Formelumsatz.
Dazu gibt es noch ΔHf (NH3). Der Subindex f bedeutet engl. formation, also Bildung. Die Energie wird deshalb auch Bildungsenthalpie (bzw. -änderung) genannt. Man findet sie in Tabellenwerken aufgelistet. Δ Hf beschreibt die Reaktionsenthalpie für den Stoff aus seinen Elementen. Sie ist im Fall von Ammoniak halb so groß wie die Reaktions-Enthalpieänderung, die den Formelumsatz beschreibt (92,28 /2 = 46,14 kJ/mol NH3).
Zum Unterschied von ΔRH und ΔHf besuchen Sie unbedingt meine Webseite.
2073
F: Ich arbeite als Redaktorin für … und recherchiere zurzeit zum Thema Nagellack und dessen Inhaltsstoffe.
Bei unseren Recherchen legen wir jeweils viel Wert auf vertrauenswürdige Quellen. Deswegen habe ich mir erlaubt, Sie anzuschreiben.
Im Zusammenhang mit Nagellack ist immer wieder der Begriff ACETON aufgetaucht. So ist dieser heute oft in Nagellackentfernern enthalten. Ich habe aber auch schon mal gehört, dass es Nagellacke mit Aceton gibt. Können Sie mjr sagen, ob Aceton aufgrund seiner chemischen Eigenschaften früher in Nagellacken verwendet wurde? Und falls nein, was gegen eine Verwendung spricht? Ich habe des Weiteren auch schon gelesen, dass Nagellack mit Nagellack entfernt werden kann. Können Sie mir sagen, ob und wenn ja, wieso (wegen welchen Inhaltsstoffen) dies möglich ist?
A: Nagellack ist wie jeder normale Lack eine Lösung von Kunststoffen (und ggf.
von Farbstoffen). Bei den Lösemitteln handelt sich um organische Substanzen wie Ester, Alkohole, zyklische Ether oder Ketone. Deshalb riechen
Lacke ganz typisch nach „Chemie“. Nach dem Auftragen des Nagellacks verdunsten diese Lösemittel und hinterlassen eine harte Kunststoffschicht.
Nagellackentferner bestehen aus nichts anderem als aus einer Mischung der gleichen Lösemittel. Eventuell enthalten sie noch Lipide, um die Haut „zurückzufetten“.
Ein typisches Keton ist das Aceton.
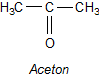
Es ist das für technische Zwecke wichtigste Lösemittel. Es ist sehr wirkungsvoll - andere sagen: es ist sehr aggressiv. So löst es mit Leichtigkeit Farben und auch viele Kunststoffe und damit auch Nagellack. Vor allem löst es aber Fette - damit leider auch den schützenden Überzug der Haut. Aceton entfettet auch die Nägel, die dann durch den aufzutragenden Lack bzw. dessen Lösemittel angegriffen werden können. Deshalb arbeitet man heute lieber mit Lacken oder Nagellackentfernern, die acetonfrei sind und stattdessen aus weniger aggressiven Lösemittel bestehen.
Da flüssige Lacke Lösemittel enthalten, kann man damit auch festen Nagellack auflösen. Deshalb soll man ja den letzten (meistens farblosen) Nagellackauftrag erst auftragen, wenn der farbige Lack der ersten Auftragung wirklich ausgehärtet ist.
Übrigens kann man eingetrocknete oder eintrocknende Nagellacke mit einigen Millilitern Nagellackentferner wieder auflösen bzw. verflüssigen.
2074
F: Vielen Dank für Ihre interessanten Schilderungen in Bezug auf Citronensäure. Wir (Bademeister) Waschen unsere T-Shirts mit 40 g
Zitronensäure in Pulverzusatz. (Auf diese Art kriegen wir die gelblichen Ränder beim Halsausschnitt weg).
Sie schreiben aber, dass es eine Ausscheidung bei Erhitzung von Calciumcitrat führt. Was heisst Erhitzung? Kann diese Ausscheidung in einer Waschmaschine bei 40°C bereits entstehen?
A: Zum Ausflocken von schwerlöslichem Ca-Citrat aus calciumhaltigen Citronensäurelösungen müssen Sie schon siedendes Wasser nehmen.
Hier ist der Versuch. Ihnen also weiterhin frohes Waschen und saubere Hemden!
2075
F: Hallo zusammen! Ich muss an meiner Schule einen Vortrag zum Thema Wasserstoff halten.
Ich verstehe aber auch nach dem hundertsten Mal durchlesen nicht, was eine Photokatalyse ist!
Ich muss wohl dazu sagen das ich was dieses Thema angeht nicht das hellste Köpfchen bin. Also bitte ich nun sie um Hilfe!
A: Mir stellt sich zunächst die Frage, wie weit Sie mit dem Referat alle wissenschaftlichen Tiefen dieses Themas ausloten
wollen oder müssen. Deshalb hier nur Definitionen:
Ein Katalysator ist ein Stoff, der eine mögliche Reaktion hervorruft, ihre Geschwindigkeit verändert oder sie in eine bestimmte Richtung lenken kann, der jedoch in der Gleichung des resultierenden Umsatzes nicht auftritt.
Fotokatalyse ist eine Katalyseform, bei der Licht als Energiequelle dient. Bekanntestes Beispiel: Schwarzweiß-Fotografie. Hier wirkt Silber als Katalysator.
Ein anderer, in letzter Zeit viel diskutierter Fotokatalysator ist feinverteiltes („Nano“) Titandioxid TiO2. In Gegenwart von UV-Strahlung (z. B. aus dem Sonnenlicht) wird an seiner Oberfläche Wasser zu Sauerstoff und Wasserstoff gespalten. Es gibt auch andere Redox-Reaktionen, die auf diese Weise katalysiert werden - z. B. der Abbau von Stickoxiden in der Luft oder die Oxidation von organischen Verunreinigungen auf Hauswänden oder Dachziegeln.
Fotokatalysen betreffen stets Redox-Reaktionen, also Reaktionen, bei denen Elektronen zwischen den Reaktionspartnern ausgetauscht werden. Die UV-Strahlung bewirkt, dass Elektronen des Katalysators angeregt werden und danach bereit sind, als Vermittler der Elektronenübertragungen zwischen den an der katalysierenden Reaktion beteiligten Molekülen zu dienen.
Solche Prozesse laufen auch bei der Fotosynthese ab. Hier wirken Stoffe wie Chlorophyll und bestimmte Farbstoffe als Fotokatalysatoren.