Prof. Blumes Tipp des Monats Februar 2012 (Tipp-Nr. 176)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Vorsicht beim Kauf von Mineralien!
Jetzt beginnt wieder die Zeit der Mineralienbörsen. Bei einem Gang über die Börse ist mir einiges aufgefallen, auf das man hinweisen sollte. Das könnte man auch zum Gegenstand des Chemieunterrichts machen.

Bild 1: Auf einer Mineralienbörse
(Foto: Blume)
Zuvor eine Bemerkung: Mineralienbörsen werden vor allem von Kindern gern besucht. Da gibt es für ein paar Euro schöne
Kristalle in vielen bunten Farben zu erstehen. Dagegen ist generell nichts zu sagen, denn damit wird die Freude
der Kinder an der Natur gefördert.
Aber beim Kaufen sollten Eltern Vorsicht walten lassen: Es gibt erstaunlich viele giftige Mineralien, die dazu noch billig sind. Heute ist es üblich, dass bei Kindergeburtstagen auch die Gäste kleine Geschenke erhalten - zum Beispiel als Belohnung bei Spielen. Dazu kaufen Eltern nicht selten vor allem bunte oder glänzende Steine, die von den Kleinen ganz besonders geschätzt sind. So brachten unsere Söhne auch schon mal Arsen-Mineralien mit nach Hause.
Giftige Mineralien
Das folgende Bild zeigt eine für nur 2 € auf einer Mineralienbörse erstandene Arsensulfid-Stufe. („Stufe“ ist der Fachausdruck
für Mineralien, die noch im Muttergestein liegen.)
Klick mich an!
Bild 2: Links: Verschiedene Arsenmineralien (Länge: 5 cm). Rechts: Auripigment
(Fotos: Blume)
Man erkennt auf dem Bild roten Realgar und gelbes Auripigment. Beides sind Sulfide;
ihre Formeln sind AsS bzw. As2S3.
Diese Verbindungen sind schon giftig genug. Der Realgar toppt das Ganze jedoch noch: Denn wenn man ihn (auch in kristalliner Form!) längere Zeit an feuchter Luft und unter Lichteinwirkung aufbewahrt, zerfällt er oberflächlich zu einem feinen Pulver, das besonders giftig ist. Hier ist eine schematische Reaktionsgleichung:
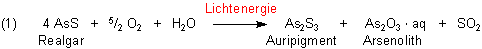
Arsenoxid As2O3 wird in der Mineralienkunde unter der Bezeichnung Arsenolith geführt; das heißt „Arsenstein“. Es ist allgemein bekannt als „Arsenik“. Das wurde früher nicht nur als Rattengift, sondern vorzüglich in Adelskreisen gern auch zur abkürzenden Regelung von Erbstreitigkeiten genutzt („Erbschaftspulver“).
Extrahiert man das lange in der Sammlung gelegene Mineral in Wasser, so wird etwas Arsenoxid gelöst. Es entsteht dabei Arsenige Säure.
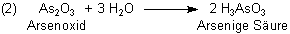
Damit sollte man einen chemischen Nachweis für Arsen führen können. Um das zu erproben, haben wir ein mindestens 25 Jahre altes Stück von Auripigment genommen, das einer meiner Söhne bei einem Kindergeburtstag bekam und das seitdem in unserer Mineraliensammlung schlummerte.
|
Versuch: Nachweis von löslichen Arsenverbindungen in Arsenmineralien
|
Klick mich an!
Bild 3: Nachweis von Arsen in einer Probe von Auripigment
(Foto: Daggi)
Die Nachweisreaktion führt zu Arsensulfid, das genauso schön gefärbt ist wie die Mineralien Auripigment und Realgar:
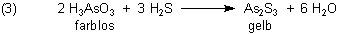
Übrigens gibt es auf Börsen auch den prächtig schwarzen, glaskopfartigen Scherbenkobalt zu kaufen. Der sieht zwar aus wie Hämatit, ist aber nichts anderes als elementares Arsen. Das Mineral war eigentlich wertlos und störte die Metallgewinnung (daher die Bezeichnung –kobalt, was an den Bergkobold erinnert, der die Bergleute foppte); es lag jedoch bei den Bergleuten in Harz und Erzgebirge auf dem Küchentisch. Wegen seiner Giftigkeit sollte es Fliegen, die sich auf den Stein setzten und an ihm schleckten, umbringen. Deshalb sprach man auch von „Fliegenstein“.
Insbesondere sind noch die Mineralien des Quecksilbers zu erwähnen. Das schönste ist der rote Zinnober (HgS). Wenn man genau hinsieht, kann man bei älteren, an Licht und feuchter Luft gelagerten Stufen ab und zu erkennen, dass aus ihnen schon das flüssige Metall tropft.

Bild 4: Zinnober mit Quecksilbertröpfchen
(Foto: Blume)
Viele Leute haben Bleiglanz (Galenit; PbS) in ihrer Sammlung. Dieses Mineral sieht wegen seiner metallisch
glänzenden Würfel oder Oktaeder wirklich prächtig aus. Auch als eigentlich äußerst schwerlösliche Verbindung setzt Bleiglanz bei längerer Lagerung
lösliche Blei(II)-Verbindungen frei, die bekanntlich wie die meisten Schwermetallsalze
giftig sind. Bleiglanz finden Steinesammler leicht auch in Deutschland - wie zum Beispiel auf den Halden oder in den Steinbrüchen von
Bleiwäsche im Sauerland.

Bild 5: Bleiglanz aus Bleiwäsche
(Foto: Blume)
Ein anderes Bleierz trägt einen unverfänglichen Namen: Vanadinit. Seine chemische Zusammensetzung ist
Pb4Cl(VO4)3. Vanadinit enthält also relativ viel Blei.

Bild 6: Vanadinit
(Foto: Blume)
Beliebtes Mitbringsel ist auch der pinkfarbene Cobaltcalcit (Co,Ca)CO3. Cobaltverbindungen gehören bekanntlich zu den Substanzen, die man im Chemieunterricht nicht mehr einsetzen soll.

Bild 7: Cobaltcalcit
(Foto: Blume)
Natürlich gibt es noch viele andere giftige schwermetallhaltige Mineralien, wie z. B. vom Nickel. Besonders heftig ist das
auch im Erzgebirge vorkommende Kupfernickel, das auch Rotnickelkies oder Nickelin genannt wird… Hinter diesem harmlos
klingenden Mineral verbirgt sich Nickelarsenid NiAs.
Künstliche Mineralien
Gerne werden auch Mineralien verkauft, die nicht in der Natur gewachsen sind, sondern aus meist gut löslichen Salzen
im Labor gezüchtet wurden. Man produziert sogar Stufen
dieser künstlichen Mineralien, indem man Granit, Kalkstein oder Sandstein in Lösungen der betreffenden Salze legt. Beim Eindunsten bilden
sich teils recht große Kristalle. Beispiele für gesundheitsschädigende künstliche Mineralien, die man oft auf Börsen sieht, sind Rotes
Blutlaugensalz (auch wenn es kein Gefahrensymbol trägt: Es kann Cyanid-Ionen freisetzen), Nickelsulfat (Xn,N), Kalium(di)chromat (T+,N)
sowie Kupfersulfat (Xn).
Klick mich an!
Bild 8: Künstliches Mineral (Kupfersulfat auf Sandstein)
(Foto: Blume)
Auch wenn Kupfersulfat mindergiftig ist, sollte man daran denken, dass kleine Kinder an diesem schönen blauen „Bonbon“ lecken
könnten und auf diese Weise größere Mengen aufnehmen. Das macht sich zumindest durch Erbrechen bemerkbar. Hier rächt es sich, dass vor
allem leicht lösliche Salze zur Erzeugung künstlicher Mineralien verwendet werden.
Feinstaub produzierende Mineralien
Prominentestes Beispiel ist der Asbest. Es handelt sich um ein Schichtsilicat, das lange Kristallfäden bildet.
Klick mich an!
Bild 9: Blauer Asbest
(Foto: Blume)
Die allgemeine Schädlichkeit von Asbeststaub ist wegen der Asbestose bekannt. Jedoch braucht man keine Angst zu haben,
ein Stück wie in Bild 5 anzufassen. Denn Asbest ist nur gefährlich, wenn er Feinstaub
im Mikrometerbereich absondert. So sollte man ihn zum Abstauben nicht gerade anpusten. Trotzdem ist es ratsam, dieses faserige Mineral
in einem geschlossenen Schächtelchen aus transparentem Kunststoff aufzubewahren.
Radioaktive Mineralien
Manche Mineralien wie die des Urans sind sogar radioaktiv - wie die schwarz-gelbe Pechblende UO2. Letztere
ist auch beliebt, weil sie im UV-Licht so schön gelb bis grün fluoresziert. Ich habe größere Stufen davon auf einem Flohmarkt im
Erzgebirge gesehen. Pechblende ist nicht nur wegen des Urans radioaktiv, sondern es setzt auch ständig das radioaktive Edelgas Radon frei.
Es gibt darüber hinaus auch (meistens prächtig schwarze) Mineralien der Seltenen Erden, die Spuren des radioaktiven Elements Thorium enthalten. Diese Mineralien bringen unwissende Urlauber in Form des schwarzen Sandes (Monazitsand) von den Stränden etwa von Ceylon (Sri Lanka) oder Brasilien als Souvenir mit nach Hause. Im Monazitsand beträgt der Thoriumgehalt aufgrund von witterungsbedingten Anreicherungsprozessen bis zu 20 Masseprozent! Das zu wissen ist wichtig für Leute, die das Hobby „Sandproben Sammeln“ betreiben. Klicke zum Beispiel hier.
Vorsicht beim Bernsteinsammeln: Es kann sich auch um weißen Phosphor handeln!
An Ostseestränden wird immer wieder Bernstein angeschwemmt und gern gesammelt. Das ist aber gar nicht so ungefährlich! Das Gefahrenpotential
verdeutlicht eine aktuelle Zeitungsmeldung von 2014:
|
Ein Steinsammler hat an der schleswig-holsteinischen Küste einen Brocken weißen Phosphors für einen Bernstein gehalten und in die Hosentasche gesteckt. Nach kurzer Trocknungszeit entzündet sich der Phosphor und setzt die Kleidung des Manns in Brand. Der Mann wird schwer verletzt. Das Landeskriminalamt weist noch einmal ausdrücklich auf die Gefahren für Bernsteinsammler hin. |
Der Grund: Nach dem Krieg wurden Phosphorkanister in der Ostsee versenkt. Die Metallbehälter korrodieren im Salzwasser und setzen ihren giftigen und brennbaren, in Wasser nicht löslichen Inhalt frei.
Die weiße Modifikation des Phosphors ähnelt dem Bernstein:
- Mit einer Dichte von d = 1,82 g/cm3 ist sie vergleichsweise leicht.
- Obwohl man von weißem Phosphor spricht, ist er eher gelb und erinnert frisch geschnitten an festes Bienenwachs.
- Dazu ist weißer Phosphor im Allgemeinen wie Bernstein von einer bräunlichen Rinde umgeben.
Bekannt ist er dafür, dass er sich in Kontakt mit Luft spontan entzündet. Deshalb wird er im chemischen Labor unter Wasser aufbewahrt. Seine niedrige Dichte sorgt dafür, dass er im Meerwasser unter der Wasseroberfläche treibt und sich somit nicht entzünden kann.
Zum Schluss
Es gibt eine Menge schöner Bestimmungsbücher für Mineralien und Gesteine. Eines haben sie gemeinsam: Bei allen fehlen Hinweise auf die
möglichen Gefahren im Umgang mit den Mineralien. Da sind die Bücher zur Bestimmung von Pilzen oder Pflanzen schon um Längen voraus…
Wenn man giftige oder schädigende Mineralien in seiner Sammlung entdeckt, sollte man jedoch nicht gleich in Panik ausbrechen und die Stücke entsorgen, sondern Vorsicht walten lassen. Als Regel gilt deshalb:
Mit Mineralien sollte man also genauso achtsam umgehen wie mit Chemikalien!
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. Januar 2015, Dagmar Wiechoczek




