Prof. Blumes Tipp des Monats Dezember 2004 (Tipp-Nr. 90)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Fiat Lux - Experimente mit dem Lichtträger Weißer Phosphor
|
Vorneweg
Deshalb könnten wir den Tipp einfach herausnehmen. Aber sehen Sie diesen Tipp als Info dazu, was man mit weißem Phosphor alles machen könnte. Zum Schluss des Tipps haben wir noch eine aktuelle Meldung, die zeigt, dass man immer noch mit weißem Phosphor konfrontiert werden kann. |
|
Versuch 1: Warum weißer Phosphor unter Wasser aufbewahrt wird
|
Leider bildet Phosphor nach längerer Zeit im Wasser eine dunkle Kruste, die aber die weiteren Versuche nicht stört.
Woher kommt das Leuchten des weißen Phosphors?
Es handelt sich um Lichtenergie, die bei seiner langsamen Oxidation freigesetzt
wird. Man spricht wegen der Namensgleichheit zwar gern von "Phosphoreszenz",
liegt hier aber mit dem Begriff Chemolumineszenz richtig. (Phosphoreszenz
ist das länger anhaltende Nachleuchten nach Bestrahlung von Gegenständen - sozusagen die
Langzeitvariante der rasch abklingenden Fluoreszenz.)
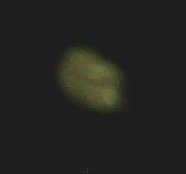
Bild 2: Leuchten von Phosphor (Foto: Daggi)
|
Versuch 2: Leuchten von Phosphor
|
Besonders deutlich wird das Leuchten, wenn man mit einem Stück Phosphor, das man in ein feuchtes Tuch eingewickelt hält, an die Tafel schreibt (z. B. das Wort "Phosphor"). Aber Vorsicht: Das halten nicht alle Tafeln aus!
Genau genommen wird der weiße Phosphor zunächst unter Wärmefreisetzung zu Phosphortrioxid
P4O6 oxidiert. Die beobachtete Chemolumineszenz erfolgt erst
bei der Weiterreaktion zu Phosphorpentoxid P4O10.
P4 + 3 O2 ———> P4O6 + Wärme
P4O6 + 2 O2 ———> P4O10 + Licht
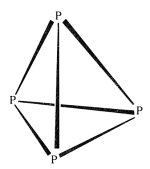
Zur Herleitung dieser Reaktionsgleichungen muss man wissen, dass die chemische Formel von weißem Phosphor P4 ist. Seine Moleküle sind (wie auch die der Oxide) tetraedrisch aufgebaut.
Obgleich der weiße Phosphor wachsartig weich aussieht, ist er erstaunlich hart!
|
Versuch 3: Schneiden von weißem Phosphor
|
An der frischen Schnittstelle erkennen wir, dass der weiße Phosphor eigentlich besser "gelber Phosphor" genannt werden sollte. Seine Farbe ist nämlich honigartig.

Bild 3 (Foto: Daggi)
Weißer Phosphor löst sich in Tetrachlorkohlenstoff oder Schwefelkohlenstoff.
|
Versuch 4: Lösen von weißem Phosphor
|
Mit dieser Lösung kann man einen schönen Versuch machen.
|
Versuch 5: Spontane Entzündung von weißem Phosphor
Achtung: Bekommt man Lösung an die (Gummi)Finger, diese sofort in die Kupfersulfatlösung tauchen und dann abspülen! Ein Phosphorbrand auf der Haut führt zu tiefgreifenden Verletzungen! Ergebnis
Entsorgung
|
| Klick mich an! |
 
  |
| Bild 4 (Fotos: Daggi) |
| Hierzu gibt es einen Film (3 MB)
Klicke hier |
Es gibt mehrere Modifikationen des Phosphors
Die bekannteste ist der makromolekulare rote Phosphor, mit dem unter anderem die Reibflächen der
Zündholzschachteln imprägniert sind. Man kann mit ihm unbesorgt experimentieren, denn er wird herstellerseitig mit
stabilisierenden Zusätzen versehen. Leider wird er bei unsachgemäßer Aufbewahrung langsam oxidiert, wobei dann Oxide
entstehen, die zudem noch hygroskopisch sind, so dass roter Phosphor im Schullabor häufig feucht ist. Will man mit
ihm experimentieren, muss man ihn vorher trocknen - zum Beispiel in einem Exsikkator über konzentrierter Schwefelsäure,
über Phosphorpentoxid oder über Kaliumhydroxid (Ätzkali; festes KOH) (C).
Roter Phosphor ist stabiler als seine weiße Modifikation. Deshalb ist er auch nicht giftig. Aus dem gleichen Grunde fängt er auch nicht schon bei Zimmertemperatur an zu brennen. Die unterschiedlichen Reaktivitäten kann man mit dem folgenden Versuch zeigen:
|
Versuch 6: Vergleich der Reaktivität von Phosphormodifikationen
Ergebnis
|


Bild 5 (Fotos: Daggi)
Übrigens wurden die Streichhölzer früher auf der Basis von weißem Phosphor
hergestellt. Das waren richtige Totmacher. Sie waren nämlich sehr giftig und
neigten außerdem dazu, sich spontan zu entzünden (in warmen Gegenden auch in
der Hosentasche!). Das hörte auf, als man die Sicherheitshölzer auf der Basis
von rotem Phosphor erfand. Davon aber in einem späteren Tipp!
Ein Blick in die Kriminalistik
Wegen seiner Giftigkeit und auch aufgrund der allgemeinen Verfügbarkeit nutzten früher
viele Schurken weißen Phosphor - zum Beispiel zur Abkürzung von langwierigen Erbschafts-Anwartschaften.
Zum kriminalistischen Nachweis solcher böser Taten erhitzte man den Mageninhalt
(zuvor gewonnen durch Magenauspumpen oder durch einen kunstvollen Bauchschnitt)
in einem Kolben mit aufgesetztem, langem Glasrohr. Wenn sich in dem Glasrohr rasch
ein Leuchten einstellte, war das der Hinweis auf eine Vergiftung durch weißen
Phosphor. (Der Mageninhalt durfte allerdings nicht wie bei Brands Versuch zur
Trockne erhitzt werden!) Das ist eines der Beispiele für die forensische Chemie.
Vorsicht beim Bernsteinsammeln: Es kann sich auch um weißen Phosphor handeln!
An Ostseestränden wird immer wieder weißer Phosphor angeschwemmt. Der Grund: Nach dem Krieg wurden Phosphorkanister in der
Ostsee versenkt. Die Metallbehälter korrodieren im Salzwasser und setzen auf diese Weise
ihren giftigen und brennbaren, in Wasser nicht löslichen Inhalt frei. Das reale Gefahrenpotential verdeutlicht eine aktuelle
Zeitungsmeldung von 2014:
|
Ein Steinsammler hat an der schleswig-holsteinischen Küste einen Brocken weißen Phosphors für einen Bernstein gehalten und in die Hosentasche gesteckt. Nach kurzer Trocknungszeit entzündet sich der Phosphor und setzt die Kleidung des Manns in Brand. Der Mann wird schwer verletzt. Das Landeskriminalamt weist noch einmal ausdrücklich auf die Gefahren für Bernsteinsammler hin. |
Die „weiße“ Modifikation des Phosphors ähnelt dem Bernstein:
- Seine Dichte ist mit d = 1,82 g/cm3 vergleichsweise gering.
- Obwohl man von weißem Phosphor spricht, ist er eher gelb und erinnert frisch geschnitten an festes Bienenwachs.
- Weißer Phosphor ist von einer bräunlichen Rinde umgeben.
Seine geringe Dichte sorgt dafür, dass er im Meerwasser treibt, allerdings unter der Wasseroberfläche. Das hat zur Folge, dass er sich nicht entzünden kann.
| Entsorgungsmaßnahmen
Alles, was mit weißem Phosphor in Kontakt gekommen ist oder sein könnte (Wasser in der Porzellanschale zum Schneiden, Messer, Pinzette, Reagenzglas zur Lösungszubereitung, überschüssige Lösung etc.) wird mit 5-10%iger Kupfersulfatlösung abgespült. Die Lösung lässt man noch einen Tag stehen und entsorgt sie dann in den Schwermetallabfall. |
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. Januar 2014, Dagmar Wiechoczek
