Wie ein Säure-Base-Indikator "funktioniert"
1.) Warum wechselt der Indikator seine Farbe?
Säure-Base-Indikatoren sind selbst schwache Säuren oder Basen im Sinne der Definition von
Brønsted, d.h. sie können Protonen abgeben. Die "Indikatorsäure" soll im Folgenden
verallgemeinernd mit HInd bezeichnet werden. Gibt die Indikatorsäure ein Proton
ab, so bildet sich die zu HInd korrespondierende Indikatorbase Ind–.
Da man Indikatoren in der Regel in wässriger Lösung verwendet, lässt sich für einen
Säure-Base-Indikator folgendes allgemeine Protolysegleichgewicht
formulieren:
![]()
(Den Fall, dass der Indikator eine Base Ind ist und durch Protonenaufnahme zur
Säure HInd+ wird, wollen wir hier nicht extra behandeln.)
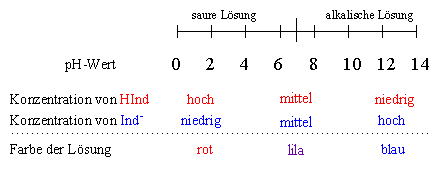
Bei einer hohen Konzentration an H3O+-Ionen (also in einer sauren Lösung),
wird das Gleichgewicht auf die linke Seite verschoben, so dass die Konzentration der Indikatorsäure
HInd größer ist als die Konzentration der Indikatorbase Ind–. Bei einer
sehr geringen Konzentration an H3O+-Ionen (also in einer alkalischen Lösung)
hingegen ist die Konzentration der Indikatorbase Ind– größer als die
Konzentration der Indikatorsäure HInd:
| pH-Wert der Lösung | Konzentration an HInd | Konzentration an Ind– |
|---|---|---|
| niedrig (saure Lösung) | groß | klein |
| hoch (alkalische Lösung) | klein | groß |
Die eigentliche Wirkung eines Säure-Base-Indikators entsteht schließlich dadurch, dass die Indikatorsäure HInd eine andere Farbe besitzt als die korrespondierende Indikatorbase Ind–. In saurer Lösung überwiegt die Konzentration der Indikatorsäure, so dass die Lösung die entsprechende Farbe annimmt. Erhöht man den pH-Wert, so steigt die Konzentration von Ind–, während die Konzentration von HInd abnimmt, bis erstere schließlich überwiegt und die Lösung die Farbe der Indikatorbase annimmt.
Ist z. B. wie beim Säure-Base-Indikator Lackmus die Indikatorsäure rot und die Indikatorbase blau gefärbt, so lässt sich dieser Vorgang wie folgt veranschaulichen:
Die unterschiedliche Farbigkeit von protonierten und nichtprotonierten Farbstoff-Molekülen bezeichnet man als Halochromie.
Welche Farben verschiedene Säure-Base-Indikatoren in sauren bzw. alkalischen Lösungen annehmen, ist auf der Seite "Säure-Base-Indikatoren" in einer Graphik bzw. einer Tabelle dargestellt.
Was bei Protonierung und Deprotonierung im Indikatormolekül abläuft, zeigt exemplarisch die Webseite: Indikator genauer betrachtet.
2.) Und wann wechselt der Indikator seine Farbe?
Fassen wir zunächst das oben gesagte zusammen:
Ein Säure-Base-Indikator ist selbst eine (schwache) Säure oder Base, die in saurer Lösung eine andere Farbe besitzt als in alkalischer Lösung.
Gibt man also einen Indikator in eine saure Lösung, und gießt man zu dieser Lösung langsam eine Lauge,
so wird sich irgendwann die Farbe der Lösung ändern. Es stellt sich dabei die Frage, wann genau
das geschieht. Etwa immer genau in der "Mitte" bei pH = 7?
Sicherlich nicht, denn dann gäbe es nicht eine so große Anzahl verschiedener Indikatoren.
Je nachdem, wie stark die Indikatorsäure HInd ist, ändert der Indikator seine Farbe
in einem bestimmten Bereich der pH-Skala, welcher etwa 2 pH-Einheiten
umfaßt. In diesem Abschnitt sind die Konzentrationen von HInd und Ind–
in der Lösung etwa gleich groß (siehe obiges Protolysegleichgewicht).
Dieser Bereich liegt
3.) Stört der Indikator nicht die Titration?
Wenn eine Säure titriert werden soll, bestimmt man bekanntlich die Zahl der freien und leicht
ablösbaren Protonen in der Lösung. Wenn man die Indikatorsäure HInd zugibt, sollte somit
die Zahl der Protonen erhöht werden. Die Konzentration der Indikatorlösungen ist verglichen
mit der zu titrierenden Säure jedoch sehr gering. Sie liegt im Allgemeinen im Bereich von 10¯4
mol/l. Der Grund hierfür ist die starke Farbigkeit der Indikatoren bzw. ihre starke Lichtabsorption.
Physikalisch gesagt: Die Werte ihrer molaren Extinktionskoeffizienten nach Lambert-Beer
sind sehr groß.
Weitere Texte zum Thema „Indikatoren“