| Klick mich an! |
 |
| Kristalle von asbestartigem Schwefeltrioxid
(Foto: Daggi) |
| Klick mich an! |
 |
| Kristalle von asbestartigem Schwefeltrioxid
(Foto: Daggi) |
Katalytische Oxidation von Schwefeldioxid
Experimente:
Versuch: Chemisorption von Schwefeldioxid an Aktivkohle
Versuch: Oxidation von Schwefeldioxid durch Stickoxide
Versuch: Oxidation von Schwefeldioxid in Gegenwart von Vanadium-Oxid
Schwefelsäure ist als eine viel verwendete Industriechemikalie von großem Interesse.
Die Herstellung von konzentrierter Schwefelsäure bereitet jedoch Probleme.
Leicht möglich ist die Oxidation von Hydrogensulfit-Ionen HSO3-, wovon man in der
Abgasentschwefelung nach dem Kalksteinverfahren Gebrauch
macht. Dabei erhält man aber keine konzentrierte Schwefelsäure. Die aber benötigt
man in der Industrie.
Früher stellte man konzentrierte Schwefelsäure durch Erhitzen von Sulfat-Hydraten
("Vitriole") her. Die Säure hieß nach diesem Verfahren auch
Vitriolöl.
Deshalb versuchte man bald, Schwefeltrioxid SO3 als Anhydrid der Schwefelsäure
herzustellen und es dann gezielt mit Wasser zu mischen.
Die Schwefeloxidation ist ein Zweistufenprozess. Bei Verbrennung schwefelhaltiger
Substanzen entsteht in der Regel immer nur Schwefeldioxid.
S + O2 ———> SO2 D H = - 297 kJ/mol
Obwohl auch die weitere Oxidation zu Schwefeltrioxid stark exotherm ist, findet sie nicht in nennenswertem Umfang statt.
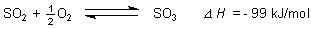
Erschwerend ist nämlich, dass die Oxidation von Schwefeldioxid eine ausgeprägte
Gleichgewichtsreaktion ist, bei der bereits mit Temperaturen ab 400-600 °C die
Rückreaktion beginnt. Andererseits ist bei diesen Temperaturen die
Reaktionsgeschwindigkeit noch zu gering, weil die Reaktion gehemmt ist.
Deshalb muss man die Aktivierungsenergie senken und nach Katalysatoren zur
Oxidation des Gases SO2 suchen.
1 Chemisorption an Aktivkohle
Diese spielt nur in geringem Umfang und dann auch nur zur Abgasreinigung eine
Rolle. Das Verfahren ist aber von der Theorie her interessant
(-> Versuch).
2 Das historische Bleikammer-Verfahren
Stickoxide als homogene Katalysatoren vermitteln die Reaktion zwischen Sauerstoff
und Schwefeldioxid (-> Versuch). Formal gilt:
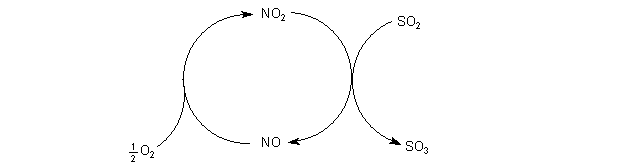
Die Gesamtreaktion beruht auf einem komplizierteren Mechanismus, den wir hier nicht
darstellen wollen.
Die so gebildete Schwefelsäure hat den Nachteil, dass sie mit Stickoxiden verunreinigt
ist.
3 Das moderne Doppelkontakt-Verfahren
Hier wirken Oxide von d-Gruppenmetallen wie Eisen, Chrom und Vanadium als
heterogene Katalysatoren. Diese Metalle können nämlich leicht ihre Oxidationszahl
wechseln und wirken daher als Sauerstoffüberträger.
Schwefeldioxid stellt man heute vorrangig durch Verbrennen von Schwefel her. Man
gewann es früher bei der Erzröstung zur Kupfer- oder Eisengewinnung.
Praktisch lässt man das Gasgemisch an einem heißen Kontakt reagieren. Es findet
ein Sauerstoffaustausch an der Oberfläche der Metalloxide statt (Kontaktverfahren;
(-> Versuch).
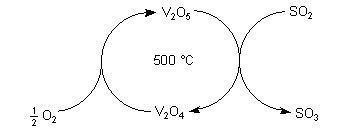
Um alles SO2 umzusetzen, führt man das Gasgemisch aus dem ersten Reaktor in einen zweiten Reaktor ("Doppelkontaktverfahren").
Weitere Texte zum Thema „Katalyse“