
Cyanokomplexe des Eisens: Die Blutlaugensalze
Experimente:
Versuch: Darstellung von Berliner Blau
Versuch: Färben mit Berliner Blau
Versuch: Oxidation von Silber durch Rotes Blutlaugensalz; Bleichen von Silber-Fotos
Versuch: Tonen von Schwarzweiß-Fotos
Blutlaugensalz - der Name sagt alles über seine klassische Herstellung aus. Die
Alchimisten haben früher alles erhitzt, was es in der Natur gab: Krötenunschlitt oder
Hirschgeweihe, Rubine in Kot und so weiter. So erhitzte man früher natürlich auch
Blut und laugte es danach mit Wasser aus. Aus der Lauge kristallisierte
anschließend das Blutlaugensalz aus. Je nachdem, wie viel Luft man beim Erhitzen
zuließ, gab es das Gelbe und das Rote Blutlaugensalz.

Bild 1: Gelbes und Rotes Blutlaugensalz
(Foto: Daggi)
Ihre Formeln sind
Gelbes Blutlaugensalz K4[Fe(CN)6] Oxidationszahl Fe: II
Rotes Blutlaugensalz K3[Fe(CN)6] Oxidationszahl Fe: III
Man erkennt, dass die Oxidationszahlen des Eisens variieren. Die CN-Anteile sind Reste aus dem Porphyrinring und dem Histidin des Hämoglobinmoleküls (Hb). So ist das Cyanid-Ion auch über sein N-Atom an das Eisen-Ion gebunden.
Heute stellt man die Salze her, indem man Eisen(II)- bzw. Eisen(III)-Salze mit Kaliumcyanid ("Zyankali") umsetzt.
Die Komplexeinheiten sind stabil und ungiftig. Sie sind sogar so stabil, dass man mit Eisen-Ionen Cyanid-Ionen unschädlich machen kann. Sie werden deshalb bei oralen Cyanidvergiftungen als Antidot verabreicht. Hier sind die Elektronenanordnungen nach der Valence Bond-Methode von Pauling:
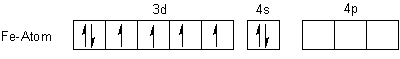
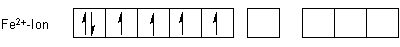

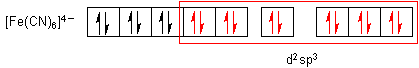
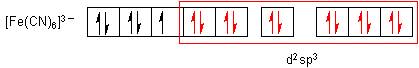
Die sechs Einzelorbitale bilden sechs energetisch gleichwertige d2sp3-Hybridorbitale. Damit ist auch die Geometrie der Komplexe festgelegt: Es handelt sich in beiden Fällen um eine oktaedrische Anordnung der Cyanid-Liganden um das Zentralteilchen.
Der Elektronenkonfiguration entnimmt man, dass das Rote Blutlaugensalz paramagnetisch ist, das Gelbe jedoch nicht.
Rotes Blutlaugensalz ist ein Oxidationsmittel
Mit der Elektronenkonfiguration kann man aber auch einen bemerkenswerten Unterschied in den
Redox-Eigenschaften von Eisen-Ionen und Eisencyano-Komplexen erklären. Freie Eisen(III)-Ionen
sind (wenn überhaupt) sehr schwache Oxidationsmittel, Eisen(II)-Ionen sind starke Reduktionsmittel.
Bei den Komplexen ist es umgekehrt: Hier sind die Hexacyanoferrat(III)-Ionen Oxidationsmittel. Das
Hexacyanoferrat(II)-Ion ist dagegen fast völlig redox-inert. Die Gründe sind:
1 Freie Eisen(II)-Ionen geben gern ein Elektron ab. Sie erreichen so eine energetische günstige, weil halbgefüllte d-Schale.
Fe2+ ![]() Fe3+ + e-
Fe3+ + e-
Man kann auch mit den in Lösung real vorliegenden Aqua-Komplexen argumentieren. Sie sind stark paramagnetische Anlagerungskomplexe mit ungestörten 3d-Orbitalen und verhalten sich deshalb bezüglich ihres Redoxverhaltens wie ihre freien Zentral-Ionen.
[Fe(H2O)6]2+ ![]() [Fe(H2O)6]3+ + e-
[Fe(H2O)6]3+ + e-
2 Die zu den Durchdringungskomplexen zählenden Hexacyanoferrat(III)-Ionen nehmen aus einem ähnlichen Grund ein Elektron auf.
[Fe(CN)6]3- + e-
![]() [Fe(CN)6]4-
[Fe(CN)6]4-
Damit füllen sie ihr "paramagnetisches" d-Orbital voll auf. Dann hat das Hexacyanoferrat(II)-Ion eine Elektronenkonfiguration wie das Edelgas Krypton erreicht, während das Hexacyanoferrat(III) eher dem Brom ähnelt.
Klick mich an!
Bild 2: Selbstgezüchteter Kristall von Rotem Blutlaugensalz
(Foto: Blume)
Rotes Blutlaugensalz ist unverzichtbar bei der Farbentwicklung
von Fotos
Hexacyanoferrat(III) dient als ein mildes Bleichmittel in der fotografischen
Chemie. Es oxidiert nämlich feinverteiltes Silber (-> Versuch).
Rotes Blutlaugensalz hat jedoch nur ein Redoxpotential von etwa 360 mV
(saures bis neutrales Milieu), Silber dagegen von 800 mV. Die Oxidation des Silbers
gelingt deshalb nur wegen eines Tricks: Es bildet sich simultan schwerlösliches
Silberhexacyanoferrat(II). Dabei wird Energie frei, die das Redoxpotential von Silber
drastisch auf E0 = 194 mV absenkt.
4 Ag + 4 [Fe(CN)6]3-
![]() Ag4[Fe(CN)6] + 3 [Fe(CN)6]4-
Ag4[Fe(CN)6] + 3 [Fe(CN)6]4-
Lies hierzu die Webseite.
Diese Eigenschaft nutzt man in der Farbfotografie. Nach der Farbentwicklung ist ein Foto oder Dia aufgrund des Bildsilbers bekanntlich schwarz und lässt keine Farben erkennen. Das Dia ist dann auch nicht transparent. Erst nach der Behandlung mit Rotem Blutlaugensalz tritt die Farbe hervor; das Dia wird durchsichtig. Das Silberhexacyanoferrat(II) löst man beim Fixieren mit heraus.
Rotes Blutlaugensalz dient auch zur Vorbereitung beim Tonen von Schwarzweißfotos (-> Versuch).
Ohne Blutlaugensalze kein Berliner Blau
Früher musste man schon aus Erkennungsgründen bunt gekleidet in den Krieg
ziehen. Es gibt eine Reihe von Farben, die für Völker typisch sind; dazu gehört das
Blau der Preußen, genannt Berliner Blau. Es bildet sich, indem man Eisen(III)-Salze
mit Gelbem Blutlaugensalz vermischt (-> Versuch).
Fe3+ + K4[Fe(CN)6] ![]() K[FeIIFeIII(CN)6] + 3 K+
K[FeIIFeIII(CN)6] + 3 K+
Die Formel K[FeIIFeIII(CN)6] beschreibt das "Lösliche Berliner Blau". Wir erhalten nur eine blaue Lösung. Wenn man eine der beiden Komponenten im Überschuss zugibt, bildet sich nach den Regeln des chemischen Gleichgewichts (Stichwort: Löslichkeitsprodukt) ein dunkelblauer Niederschlag, das "Unlösliche Berliner Blau". Das sehen wir auch im folgenden Bild. Seine Formel ist komplizierter:
FeIII [FeIIFeIII(CN)6]3

Bild 3: Berliner Blau
(Foto: Daggi)
Der Farbstoff ist recht flockig und schwer auf der Faser zu fixieren. Deshalb bildet
man ihn direkt auf der Faser (-> Versuch). Solche
Farbstoffe nennt man Entwicklungsfarbstoffe.
Die Farbigkeit von Berliner Blau beruht auf der Anwesenheit eines Elements in verschiedenen Oxidationsstufen, hier Eisen mit +II und +III. (Das kennt man vom roten Blei(II,IV)-oxid, der Mennige Pb3O4, oder vom schwarzen Eisen(II,III)-oxid, dem Magneteisenerz Fe3O4.) Zwischen den Eisen-Ionen findet nämlich ein reger Elektronenaustausch statt. Daraus resultiert die leichte Anregbarkeit dieser Elektronen. Das erkennt man schon daran, dass sich mit bei reziproker Versuchsführung (also Gabe von Fe(III) zu Gelbem bzw. von Fe(II) zu Rotem Blutlaugensalz) deutlich der gleiche Farbstoff bildet. Früher machte man in der Benennung Unterschiede. Der andere Farbstoff hieß damals Turnbulls Blau.
Beim Arbeiten mit Berliner Blau stellt man rasch fest, dass es penetrant färbt. Um es zu entfernen, reicht es aber aus, es mit Sodalösung abzuspülen; in alkalischem Milieu löst es sich nämlich leicht auf (-> Versuch). Das ist ein Grund dafür, dass die Soldaten früher nicht ihre Kleidung gewaschen haben. Das war im "Feld" sowieso kaum möglich oder sinnvoll.
Bleibt noch die Frage, warum die Österreicher mit weißen Uniformen in den Krieg zogen. Genaugenommen waren die Uniformen nicht weiß, sondern nur ungefärbt. Die Österreicher konnten sich nämlich das teure Färben nicht leisten.
Weitere Texte zum Thema „Komplexverbindungen“