
Exemplarische Festkörper: Die Modifikationen des Kohlenstoffs
Experimente:
Versuch: Vergleich der Modifikationen von Kohlenstoff
An den drei Modifikationen des Kohlenstoffs
1. Diamanten
Diamanten (griech.: adamas = der Unbezwingbare) haben einen hohen Schmelzpunkt und
sind besonders hart. Mit einer Ritzhärte 10 steht der Diamant an der obersten Stelle in der
Mohsschen Härteskala. Denn es müssen kovalente Bindungen
aufgebrochen werden, wenn der Kristall zerstört werden soll.
Das dreidimensionale Gitter hat eine kubische Struktur (Bild 1). Deshalb findet man den
Diamanten auch als Würfel, Tetraeder oder Oktaeder. Die Kristalle sehen dann z. B. aus wie die
vom Alaun (Bild 1 rechts). Die Fotos kann nur ein Fachmann unterscheiden…

Bild 1: Diamantgitter und Alaunkristall als Diamantplatzhalter
(Fotos: Blume)
Die Raumnetzstruktur bildet sich, indem die C-Atome durch vier Bindungen mit den
benachbarten Atomen verbunden sind. Da alle Außenelektronen der C-Atome an Bindungen
beteiligt sind, besitzt der Diamant keinerlei elektrische Leitfähigkeit; er ist ein Isolator,
der zusätzlich auch in dünnsten Schichten noch besonders abriebfest ist. (Das ist
wichtig für seine Verwendung in der Halbleitertechnik.)
Das Fehlen freier, also durch Licht leicht anregbarer Elektronen führt auch dazu,
dass die Diamanten transparent sind, also kein Licht absorbieren. Die Folge ist ihr hoher
Brechungsindex, der sie zum geschätzten Rohstoff von Schmuck-Brillanten macht.
Hinzu kommt, dass die Stärke des Diamantgitters Schwingungen erlauben, die den Diamanten zu hervorragender Wärmeleitung befähigen. Dadurch ist der Diamant der Festkörper mit der höchsten Wärmeleitfähigkeit, den wir kennen. Auch das ist für technische Anwendungen des Diamanten z. B. in der Infrarot-Technologie und als Bohrkopfbesatz besonders wichtig.
2. Graphit
Die Graphitmine in deinem Bleistift hat eine Schichtstruktur und ist so weich, dass
du damit schreiben kannst. Im Graphit (griech.: graphein =
schreiben) (Bild 2) ist jedes Kohlenstoffatom durch gleich lange Atombindungen mit drei anderen
Kohlenstoffatomen verbunden. Der Bindungswinkel beträgt 120 °, so dass sich
regelmäßige Sechsecke bilden. Folglich gehört der Graphit zu den Kristallen mit
hexagonaler Symmetrie. (Solche Kristalle findet man aber nur äußerst selten. Er tritt vor allem
unregelmäßig tafelig auf (Bild 2).)
Jedes Kohlenstoffatom besitzt noch ein Elektron, das keine Bindung eingeht. Die
"übrige", vierte Bindung jedes Atoms bildet Doppelbindungen, ist
aber nicht fest an bestimmte Plätze gebunden, ähnlich wie die Elektronen in
Metallen ist das Elektron beweglich innerhalb einer Schicht. So
lassen sich der fast metallische Glanz und die elektrische
Leitfähigkeit erklären. Graphit ist lichtundurchlässig,
denn die freien Elektronen halten Licht auf.
Die Schichten des Graphitgitters haben wesentlich größeren Abstand voneinander als
die Atome innerhalb einer Schicht und werden durch schwache Van-der-Waals-Kräfte
zusammengehalten. Daher ist Graphit ein sehr weiches Material, leicht spaltbar
und kann sogar als Schmiermittel verwendet werden.
 |
| Bild 2: Graphitgitter und Graphitkristall (Fotos: Blume) |
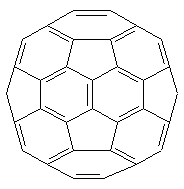
3. Fullerene und Nanotubes
Die dritte Modifikation des Kohlenstoffs, die Fullerene,
gehört zu den Molekülkristallen. Dass Fullerene aus kleinen
Molekülen bestehen, zeigt sich daran, dass sie im Gegensatz zu Diamant und Graphit
in Benzol bzw. Toluol leicht löslich sind. Ihre Kristalle sind recht weich. Das weist auf die
Hohlräume der C60-Käfige und deren lockerem Zusammenhalt hin. Wusstest du, dass die
C60-Fußbälle im Kristall mit hoher Geschwindigkeit rotieren?
 |
 |
| Bild 3: Molekül und Kristalle des C60-Buckminsterfullerens (Foto: Blume) |
Interessantes rund ums Thema Fullerene kannst du auch auf der Seite 'Fullerene - Was hat Fußball mit Chemie zu tun?' unseres Servers nachlesen.
Mittlerweile kennt man noch eine Abwandlung der Fullerene, die Nanotubes (engl. tube, Röhre). Es handelt sich um lange Röhren, die aus Kohlenstoff-Sechsringen zusammengesetzt sind.
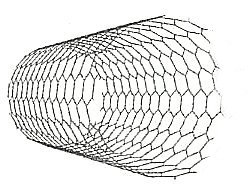
Bild 4: Nanotube- Ausschnitt
4. Graphene
In letzter Zeit gewinnt diese neue Kohlenstoffmodifikation neben den mit viel Vorschusslorbeeren bedachten
Fullerenen und Nanotubes immer mehr an Bedeutung. Dabei handelt es sich um Schichten von
Kohlenstoffatomen, die nur eine Atomlage „dick“ sind und somit den Nano-Substanzen zuzuordnen sind. Sie verfügen
über höchst ungewöhnliche mechanische und elektrische Eigenschaften. Hinzu kommt eine extrem hohe Wärmeleitfähigkeit,
die die des bisherigen „Champions“ Diamanten noch weit übertrifft.
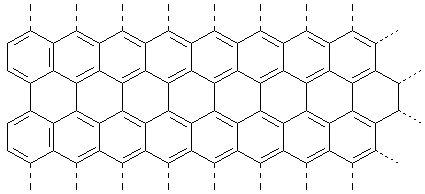
Bild 5: Graphenfolie
Graphene bestehen aus Sechseck-Waben, die wir schon vom Graphit her kennen. Da die Kohlenstoffatomschicht nur
zweidimensional ist, enthalten Graphene (verglichen mit Graphit) besonders viele nichtbindende Elektronen, die weiträumig
delokalisiert sind. Man kann sagen, dass das planare Wabennetz des Graphens aus lauter Benzolringen zusammengesetzt ist.
Das ist vergleichbar mit polykondensierten Aromaten (PAK).
Es gibt eine Vielzahl von Synthesemöglichkeiten. So hat man zu allererst auf bestimmten Oberflächen fixierte Graphitblöcke auf eine Weise abgezogen, dass eine Graphen-Schicht auf der Unterlage zurückblieb. Das erinnert an das Abziehen eines Klebestreifens. Andere Synthesen (von denen es mittlerweile eine Vielzahl gibt) gehen von kleinen Molekülen aus, die auf besonderen Unterlagen zur Reaktion gebracht werden.
Beispielsweise werden Graphenbänder (Nanostreifen) aus Monomeren auf der Basis von polykondensierten Aromaten synthetisiert. Durch die Wahl der Ausgangssubstanzen kann man Länge und Breite der Bänder sowie die Strukturen der Ränder beeinflussen und damit die Eigenschaften der Nanostreifen wie gewünscht variieren.
Ein derartiges Monomer ist z. B. bromiertes Bianthryl.
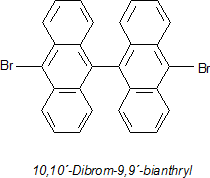
Die Monomeren werden auf einer Gold- oder Silberoberfläche erhitzt. Dabei spalten sie die Bromatome ab. Die so entstandenen
Kohlenstoffradikale verknüpfen sich untereinander zu langen Bändern. Noch stärkeres Erhitzen führt zur Eliminierung von Wasserstoff,
wobei auch neue C-C-Bindungen geknüpft werden. Die Absättigung der Ränder erfolgt durch die verbleibenden randständigen Wasserstoffatome.
Zum Schluss liegt ein flaches Graphenband vor, das von der Metallunterfläche abgelöst wird. Der auf diese Weise erhaltene Nanostreifen
würde so aussehen:
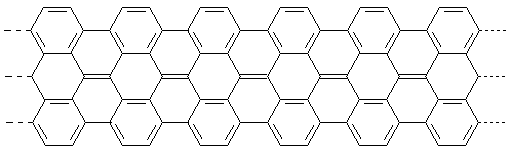
Bild 6: Graphen-Nanostreifen
Wie zu erwarten ist, sind diese Streifen je nach Länge intensiv gefärbt.
Vom Graphit zum Diamant und zu den Fullerenen
Da sowohl Graphit als auch Diamant aus Kohlenstoffatomen aufgebaut sind, wirst du dich
vielleicht fragen, warum man nicht aus billigem Graphit wertvolle Diamanten herstellt. Dazu
müsste man nur die Anordnung der Atome ändern. Wenn das aber so einfach
wäre, könnte jeder die kostbaren Schmuckstücke selbst herstellen.
Diamanten haben eine größere Dichte als Graphit, die Atome im Diamanten sind enger
gepackt. Deshalb muss Graphit unter hohem Druck erhitzt werden, damit die Atome eine dichtere
Ordnung einnehmen. Bei einem Druck von etwa 100 000 bar und einer Temperatur von etwa 1500 - 1800
°C werden aus Graphit Industrie-Diamanten gewonnen.
Da dieser Prozess sehr aufwendig ist, sind die gewonnenen Diamanten nicht gerade billig.
Sie werden vor allem als Werkzeuge zum Schneiden, Bohren und
Schleifen eingesetzt. Heute werden vor allem in Rußland große Diamanten von hervorragender
Qualität künstlich produziert. Sie überschwemmen den Markt und sind von den natürlichen nur
aufgrund ihrer hohen Reinheit zu unterscheiden.
Verdampft man Graphit bei geringem Druck in einer Heliumatmosphäre, so schlägt sich der Kohlenstoff an kalten Stellen des Reaktionsgefäßes als Fulleren-Mischung nieder.
Erhitzt man weiterhin eine mit Fullerenen belegte Fläche, erhält man dünne Diamantschichten. Diese sind mechanisch außerordentlich stabil und hart, außerdem transparent, hervorragend Wärme ableitend und beste Isolatoren. Deshalb spielen sie in der Mikro-Elektronik eine wichtige Rolle.
Kohle und Ruß
Kohle ist keine Kohlenstoffmodifikation. Genau genommen handelt es sich um einen kompliziert
zusammengesetzten Kohlenwasserstoff.

Bild 7: Steinkohle
(Foto: Blume)
Zum molekularen Aufbau der Kohle klicke hier.
Anders als Kohle besteht Ruß aus einer Kohlenstoff-Modifikation, denn Ruß ist eine Ansammlung von kleinen, meist kugelig angeordneten Graphitkristallen.
Weitere Texte zum Thema „Kristalle“