Kristallgitter
Experimente:
Versuch: Vergleich verschiedener Festkörper

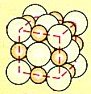
Bild 1: Maßstabgerechtes Kristallgittermodell von Natriumchlorid (Kochsalz)
Ein Kristall besteht aus einer dreidimensionalen-periodischen Anordnung von Teilchen. Man
spricht von einem Kristallgitter oder auch
Raumgitter (siehe Bild 1).
Atome, Ionen oder Moleküle nehmen einen bestimmten Platz in diesem Gitter ein und werden
durch die Gitterkräfte zusammengehalten. Die Teilchen berühren
einander, und der freie Raum zwischen ihnen ist äußerst gering (Bild 1).
Man spricht von dichten oder sogar von
dichtesten Packungen.
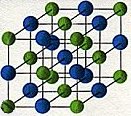
Bild 2: Kristallgittermodell von Natriumchlorid (Kochsalz)
Das Bild zeigt, wie ein Kristallgitter veranschaulicht wird. Die Teilchen werden nicht in ihrer relativen Größe gezeichnet.
Vielmehr wird an den Ort ihres Mittelpunkts eine kleine Kugel gesetzt, die durch Geraden bzw. Stäbe mit anderen verbunden ist.
Die Stäbe sollen keine Verbindungsrichtung symbolisieren, sie dienen nur dem Zusammenhalt des Modells.
Der kleinste Ausschnitt aus einem Kristallgitter ist die Elementarzelle.
Alle vorkommenden Teilchensorten nehmen in der
Elementarzelle ihren festen Platz ein. Dadurch lässt sich auch das
Gesetz der Winkelkonstanz erklären.
Um einen Kristall vollständig zu beschreiben, genügen Informationen aus einer
einzigen Elementarzelle: Ihre Abmessungen (Gitterkonstante), die Winkel
und die Anordnung der Atome. Aus der Symmetrie der Elementarzelle ergibt sich das
Kristallsystem.
Die Teilchen in einem realen Kristall sind nicht starr angeordnet, sondern schwingen um ihren Mittelpunkt. Bei zunehmender Temperatur können die Schwingungen der Gitterbausteine so stark sein, dass die Gitterkräfte nicht mehr ausreichen, um den Kristall zusammenzuhalten. Je nachdem wie stark die Kräfte sind, bricht das Raumgitter früher oder später zusammen, d. h. der Kristall schmilzt oder sublimiert (wie Eis oder Iod).
Die folgende Tabelle fasst die Typen von Kristallgittern zusammen, die in Festkörpern vorkommen. Der Tabelle entnimmst du auch, dass die Gitterkräfte in den Festkörpern sehr unterschiedlich sein können. Ihre Art und Größe hängen von den Bausteinen des Gitters ab. Das manifestiert sich vor allem in den Schmelzpunkten (-> Versuch). Auch innerhalb eines Gittertyps variiert der Zusammenhalt der Teilchen sehr stark. Das wird ganz besonders bei den Metallen deutlich.
| Gittertyp | Gitterbaustein | Gitterkräfte | Eigenschaften | Charakteristische Beispiele |
| Ionengitter | Ionen | Starke elektrostatische Bindungskräfte (Coulombsche Kräfte) |
Hoher Schmelzpunkt, hart, Ionenleitung in der Schmelze | Natriumchlorid
Feldspat Calciumfluorid Magnesiumoxid Pyrit |
| Molekülgitter | Moleküle | London-van der Waals-Kräfte Dipol-Dipol-Kräfte |
Niedriger Schmelzpunkt, weich, Isolator | Iod
Schwefel Wasser Rohrzucker Citronensäure Naphthalin Kohlenstoffdioxid Fullerene |
| Atomgitter | Atome | Bindungskräfte der Atombindung | Hoher Schmelzpunkt, hart, Isolator oder Halbleiter | Diamant
Graphit Quarz |
| Metallgitter | Metall-Ionen | Unterschiedlich starke Bindungskräfte der
Metallbindung
(Coulombsche Kräfte) |
Unterschiedliche Schmelzpunkte, duktil, Elektronenleiter | Zinn
Bismut Gold Platin |
Allerdings lassen sich nicht alle Festkörper in ihren Eigenschaften so eindeutig
charakterisieren, wie Tabelle 1 suggeriert. Salzhydrate (wie Alaune, Glaubersalz und Bittersalz)
z. B. zeigen oft zunächst einen niedrigen Schmelzpunkt ("Sie schmelzen in ihrem
Hydratwasser"). Nach Verdampfen des Wassers bleibt allerdings eine feste Substanz mit dem
für Ionengitter typisch hohem Schmelzpunkt zurück.
Andere ionische Substanzen wie Kaliumnatriumtartrat (Seignettesalz) oder
Kaliumhexacyanoferrat(III) (Rotes Blutlaugensalz) zersetzen sich beim Erhitzen - wie auch
viele Molekülgittersubstanzen (z. B. Saccharose).
Außerdem gibt es Übergänge zwischen den Gittertypen: Siliciumkristalle sind zwischen Atom- und Metallgittern einzuordnen. Silicate und Alumosilicate bestehen aus großen "Atomgittern mit ionischen Einlagerungen".
Wie sieht die Außenschicht eines Kristalls aus?
Schüler stellen oft die Frage, wie sich ein Kristall nach außen hin absättigt.
Denn es bleiben an Kanten und Flächen Bindungen offen, die irgendwie mit der Umgebung
reagieren müssen.
Ionenkristalle adsorbieren Wasser und andere Dipolsubstanzen.
Metallkristalle überziehen sich mit einer Oxidschicht, adsorbieren dazu noch Sauerstoff-
bzw. Stickstoffmoleküle.
Atomgitter wie beim Diamant oder Graphit bilden einen Pelz von Wasserstoff-Atomen. Sie sind
also genau genommen Kohlenwasserstoffe. Darin unterscheiden sie sich von Fullerenen, die
somit die einzige reine Kohlenstoff-Modifikation darstellen.
Quarzkristalle sättigen sich mit Luftmolekülen oder Wasser ab.
Molekülgitter aus polaren Substanzen wie Rübenzucker binden ebenfalls
Wassermoleküle.
Anisotropie
Die Gitterstruktur bedingt eine grundlegende Eigenschaft von Kristallen, die Anisotropie.
Ein Stoff ist anisotrop, wenn in ihm physikalische und chemische Kräfte in den verschiedenen
Richtungen des Raumes verschiedenartig wirken.
Je nach Kristallgittertyp sind z. B. Spaltbarkeit, Härte, Pleochroismus, Zähigkeit,
Piezoelektrizität, Lichtbrechung und Glanz in den verschiedenen Richtungen des Raumes ungleich
ausgeprägt.
Stoffe, die in allen Richtungen identische Eigenschaften besitzen, bezeichnet man als
isotrop. Hierzu gehören die festen, amorphen Stoffe (z. B. Gläser, Harze), die meisten
Flüssigkeiten und Lösungen sowie die Gase.
Anisotropie zeigen auch die Flüssigkristalle.
Weitere Texte zum Thema „Kristalle“