 |
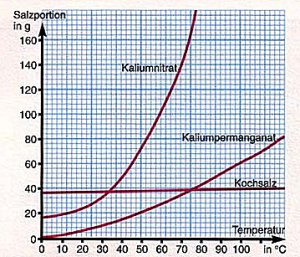
| Löslichkeit von Salzen auf 100 g Wasser
(Graphik: Cornelsen) |
Alles um´s Schmelzen, Sublimieren und Lösen
Experimente:
Versuch: Löslichkeit und Korngröße
Versuch: Löslichkeit und Temperatur
Versuch: Lösungswärme, Volumenveränderung und
Siedepunktserhöhung
Schmelzen, Sublimieren und Lösen haben eines gemeinsam: Die Bausteine der
Kristalle werden voneinander gelöst und vereinzelt. Energetisch geht es stets darum,
die Wechselwirkung der Bausteine zu überwinden. Das kann durch Wärmezufuhr mit
der Folge der Änderung des Aggregatzustands erfolgen (Schmelzen, Sublimieren)
oder durch Einwirkung von Lösemitteln (Lösen).
1. Schmelzen
Hier wird nur Schmelzwärme DHschmelz
zugeführt.
2. Sublimieren
Beim Sublimieren erfolgt der Übergang vom Feststoff direkt in den gasförmigen
Zustand. Deshalb ist eine vergleichsweise hohe Energie aufzuwenden:
DHsublimation = DHschmelz + DHverdampfung
3. Lösen
Beim Lösen von Salzen oder anderen Stoffen handelt es sich um eine
Wechselwirkung zwischen dem zu lösenden Stoff und dem Lösemittel. Bei Salzen und
Wasser ist es die Wechselwirkung zwischen Ionen und Dipolen.
Damit ist die Lösungsgeschwindigkeit auch eine Frage der Oberfläche, also der
Korngröße des zu lösenden Stoffs (-> Versuch).
Beim Lösen bilden sich Hydrathüllen um die Ionen. Durch die
Hydrathüllenbildung wird das Volumen des Wassers vermindert, so dass die Volumenzunahme
beim Lösen von Salz in Wasser wesentlich geringer ist, als man nach dem Volumen des zugegebenen
Stoffs erwarten sollte (-> Versuch).
Warum kühlt Wasser beim Lösen von Salz ab, obwohl es sich bei der
Ion-Dipol-Wechselwirkung um einen exothermen Vorgang handelt? Es muss die wesentlich
höhere Gitterenergie (-> Born-Haberscher Kreisprozess)
überwunden werden. Das wird dadurch unterstützt, dass die Wärmebewegung der
Wasser-Moleküle durch Bildung der Hydrathüllen um die Ionen eingeschränkt wird.
Es wird also Energie gewonnen auf Kosten der Entropie des Systems; dieses kühlt ab.
Das Lösen wird deshalb durch Temperaturerhöhung unterstützt (->
Versuch). Allerdings ist die Löslichkeit verschiedener Salze
in Abhängigkeit von der Temperatur unterschiedlich. So verändert sich beispielsweise
die von Kochsalz kaum, während die von Kaliumnitrat stark zunimmt (-> Grafik).
Umgekehrt beobachten wir eine Siedepunktserhöhung, wenn wir Salze in Wasser
lösen. Denn die Dipole müssen wieder von Ionen getrennt werden, wenn sie in die
Dampfphase überwechseln wollen. Gleiches gilt natürlich auch für den Gefrierpunkt
von Salzlösungen: Dieser sinkt aus dem gleichen Grunde, allerdings wechseln hier die
Lösemittelmoleküle in die reine feste Phase über.
Der Umfang der Erhöhung bzw. Erniedrigung ist eine Frage der
Stoffmengenkonzentration, also der Molzahl (-> Versuch). Wir
sprechen hier von kolligativen Eigenschaften. 1 Mol Teilchen einer Substanz wie Zucker
bewirkt bei Wasser eine molare Siedepunktserhöhung von 0,512 °C. Bei Kochsalz messen wir
die doppelte Erhöhung: Denn das Salz bildet pro Formeleinheit zwei Ionen.
 |
| Löslichkeit von Salzen auf 100 g Wasser
(Graphik: Cornelsen) |
Lies in diesem Zusammenhang auch die Webseiten
Mit Kältemischungen gibt es auch im Sommer Eis
Wärmekissen: Schnelle Wärme aus Kristallen
Weitere Texte zum Thema „Kristalle“