
Die Analyse von Kochsalz
Experimente:
Klicke hier
Kochsalz ist Natriumchlorid, NaCl. Es ist aus den Ionen Na+ und Cl-
aufgebaut. Letzteres ist das Chlorid-Ion.
Die qualitativen Nachweise der Ionen von Natriumchlorid
Die Methoden sind im Schulalltag wohl bekannt.
Für Natrium und seine Verbindungen nutzt man die typisch gelbe Flammenfärbung. Im Taschenspektroskop sieht man zwei eng beieinander liegende Linien bei 588 nm.

Linienspektrum von Natrium
Wie kann überhaupt eine Lichtemission zustande kommen? Im Natriumchlorid sind doch nur Natrium-Ionen enthalten. Licht strahlen die nur aus, wenn sie Elektronen aufnehmen.
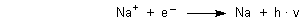
Wo kommen die Elektronen her? Sie entstehen unter anderem durch Reaktion von Na+ mit
den Chlorid-Ionen. Denn in der Hitze eines Brenners hängen die beiden wie NaCl-Moleküle
zusammen. Außerdem bilden sich in der Flammenhitze bei der Verbrennung des Gases Ionen und Elektronen -
dieses Nebeneinander von entgegengesetzt geladenen Teilchen nennt man „Plasma“.
Chlorid weist man mit Silbernitrat nach. Das entstandene schwerlösliche Silberchlorid ist in Ammoniakwasser unter Bildung des Diamminsilberkomplexes löslich.
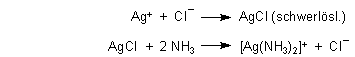
Die quantitativen Nachweise der Ionen von Natriumchlorid
Diese Verfahren sind wichtig für die Lebensmittelchemie oder Wassergütebewertung.
Chloridbestimmung
Gravimetrische Bestimmung
Früher wurde aus einem bestimmten Lösungsvolumen Silberchlorid gefällt, abgetrennt, gewaschen, getrocknet und
gewogen. Aus der Masse wurde die Chloridmenge berechnet.
Volumetrische Titrationen
Hier gibt es verschiedene Methoden. Wichtig ist wie bei jeder Titration die Bestimmung des Endpunkts
(Äquivalenzpunkt).
A Bei Erreichen des Endpunkts flockt das zuvor milchig aussehende (also kolloidale) Silberchlorid schlagartig aus. Das liegt daran, dass zunächst die noch im Überschuss vorhandenen Chlorid-Ionen die Oberfläche der AgCl-Kolloide besetzt hielten. Dadurch waren die negativ aufgeladen und stießen sich ab; die Emulsion war stabil. In dem Moment der Äquivalenz entfallen die Oberflächenladungen; die Kolloide lagern sich schlagartig zu groben Partikeln zusammen; der bekannte, käsig aussehende AgCl-Niederschlag entsteht.
B Methode nach Mohr: Man gibt zur Chloridlösung eine Spur von Chromatlösung zu. Bei Erreichen der Äquivalenz fällt aufgrund des überschüssigen Silbernitrats schlagartig rotbraunes Silberchromat aus.
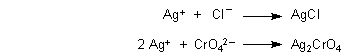
Ursache: Es konkurrieren also zwei Fällungsreaktionen. Silberchlorid ist zwar leichter löslich als Silberchromat. Anders gesagt, das Löslichkeitsprodukt von Silberchlorid ist mit 10-10 deutlich größer als das von Silberchromat (4 · 10-12). Aber wegen des großen Chloridüberschusses und der geringen Chromatkonzentration wird das Löslichkeitsprodukt des Silberchromats, in das ja auch das Produkt der Konzentrationen der Silber-Ionen eingeht, erst erreicht, wenn Silber-Ionen im kleinen Überschuss vorliegen.
C Methode nach Fajans: Man gibt zur Lösung einen negativ geladenen Farbstoff wie
Eosin zu. Bei Erreichen des Äquivalenzpunkts flockt der AgCl-Niederschlag aus und
färbt sich dabei intensiv rot.
Ursache: Die anfangs überschüssigen Chlorid-Ionen laden die Kolloide negativ auf, so dass Eosin nicht andocken kann.
Wenn der Endpunkt der Titration erreicht ist, lagern sich umgekehrt positiv geladene Silber-Ionen an und an diese dann die
Farbstoffmoleküle.
Potentiometrische Titrationen
Man hat eine Silberelektrode, deren Potential von der Chlorid-Ionenkonzentration abhängt. Legt man eine Chloridlösung
vor und gibt man Silbernitratlösung zu, so steigt das Potential in der Lösung an. Man erhält eine sigmoidale Kurve, deren
Wendepunkt der Äquivalenzpunkt ist.
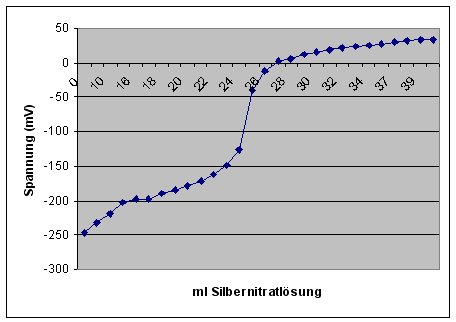
Potentiometrische Titrationskurve von Chlorid mit Silbernitrat
(Vorlage 25 ml NaCl-Lösung (c = 0,01 mol/l); AgNO3-Lösung (c = 0,01 mol/l).)
Messbedingungen
Ionensensitive Elektroden
Das sind speziell gebaute Elektroden, die nur auf eine Ionenart ansprechen, so auch auf Chlorid-Ionen.
Natriumbestimmung
Eigentlich würde es ausreichen, die Menge an Chlorid zu bestimmen. Denn daraus ergibt sich der Wert für Natrium
automatisch.
Die Menge des Natriums kann man spektroskopisch bestimmen, wobei die Atomabsorption (Flammenfotometrie) im Vordergrund steht. Bei diesem Verfahren wird die Probe hoch erhitzt, wobei sich wie oben schon gesagt Natriumatome bilden. Bestrahlt man die mit dem gelben Licht einer Natriumdampflampe, so werden die Natriumatome in der Probe angeregt und absorbieren Licht („Resonanz“). Aus dem Maß der Absorption kann man auf die Menge an Natrium in der Probe schließen.
Weitere Texte zum Thema „Salz“