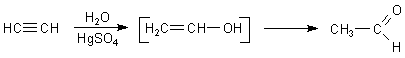
Auf chemischem Weg zum Aldehyd
Experimente:
Versuch: Ein historisches Experiment - Scheeles Entdeckung der Aldehyde
Versuch: Darstellung von Ethanal durch Dehydrierung von Ethanol
Versuch: Oxidation von Alkoholen und Ketonen an Kupferdraht
Versuch: Darstellung von Ethanal aus Ethanol durch Oxidation mit schwefelsaurer
Kaliumdichromatlösung
Die ersten Aldehydsynthesen liegen weit zurück. Der schwedische Chemiker Carl Wilhelm Scheele
tat es aus Versehen und Justus von Liebig mit Vorsatz, doch das Ergebnis war dasselbe: Der
Aldehyd. Es gab viele Chemiker, die sich mit dem Problem der Aldehydsynthese beschäftigt haben. Das
Ergebnis dieser jahrelangen Studien ist, dass wir heute über einen sehr großen Fundus an Möglichkeiten
verfügen, Aldehyde darzustellen. Während die ersten Chemiker ausschließlich auf die Oxidation von primären
Alkoholen zurückgriffen, reichen die heutigen Möglichkeiten über das gesamte Spektrum der chemischen
Reaktionen. Eine Auswahl wird im Folgenden dargestellt. Diese Suche nach der besten Synthese zeigt aber
auch, wie wichtig Aldehyde für die Chemie sind!
1 Addition von Wasser an Ethin
Dies ist eine alte Methode zur Herstellung von Acetaldehyd. Sie diente letztlich auch zur Herstellung
von Ethanol (so genannter "Carbidsprit").
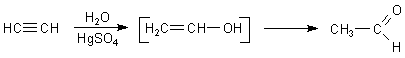
Ihr Nachteil ist die Verwendung von Quecksilbersalzen als Katalysator. Sie war Ursache für das Unglück in der Minamata-Bucht in Japan. Wir beschreiben diese Methode hier.
2 Darstellung von Aldehyden durch Oxidation von Alkohol
Eine Möglichkeit, Aldehyde im Labor herzustellen, ist die der Oxidation. Als Oxidationsmittel verwendet
man hierbei in der Regel Kupferoxid, welches dann selbst zu Kupfer reduziert wird. Diese Reaktion ist
allerdings nicht für alle Aldehyde geeignet. Sie funktioniert lediglich bei der Darstellung von Formaldehyd
oder Acetaldehyd.
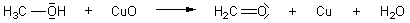
3 Darstellung von Aldehyden durch Dehydrierung von Alkohol
Betrachtet man die Summenformel der Aldehyde, so stellt man fest, dass zwischen den Formeln der Aldehyde
und denen der Alkohole lediglich zwei Wasserstoffatome liegen. Nun kann man den Wasserstoff auch direkt abspalten.
Diese Reaktion wird als Dehydrierung bezeichnet. Dabei wird auf Silber oder auch Platin als
Katalysator zurückgegriffen.
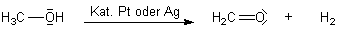
Diese Reaktion findet auch im Industriemaßstab statt, im Besonderen zur Darstellung von Formaldehyd aus Methanol.
4 Darstellung von Aldehyden durch Ozonolyse von Alkene
Das Molekül O3 (Ozon) ist eines der stärksten Oxidationsmittel der Chemie. Versetzt man Ozon
mit Alkenen, so wird das Alken an seiner Doppelbindung gespalten und es entstehen zwei Alkanale. Wichtig
ist eine nicht zu hohe Temperatur, da die Oxidation sonst weitergeht.
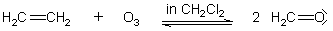
(Zur Ozonolyse von ungesättigten Verbindungen klicke hier.)
5 Darstellung von Aldehyden durch Oxidation mit Chrom(VI)-Verbindungen
Primäre Alkohole werden durch Kaliumchromat oxidiert. In der Regel wird zusätzlich konzentrierte
Schwefelsäure als Katalysator eingesetzt. Wir kennen diese Reaktion von den
Atemalkoholproben mittels Pusteröhrchen, die sich dabei aufgrund
der Reduktion von Chrom(VI) zu Chrom(III) grün verfärbten. Allerdings ist es zur Aldehydsynthese notwendig,
unter Wasserausschluss zu arbeiten, da es ansonsten zu einer Weiteroxidation zur Carbonsäure kommen kann.
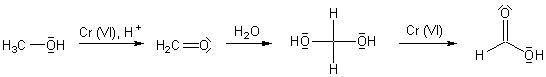
Ein milderes Oxidationsmittel ist Mangandioxid. Diese Synthese ist die von Scheele zuerst angewandte Reaktion.
6 Darstellung von Aldehyden durch Hydroformylierung (Oxosynthese)
Eine der bewährtesten Methoden zur Darstellung von Aldehyden ist die hydrierende Carbonylierung (Hydroformylierung)
von Alkenen. Bei dieser Darstellungsart handelt es sich um eine Addition von CO (Kohlenstoffmonoxid) an die Doppelbindung
eines Alkens. Diese Reaktion liefert bei passenden Ausgangsstoffen nahezu alle Aldehyde. Das Alken
wird mit Synthesegas (H2 + CO) in Gegenwart von Rhodium- oder Cobalt-Katalysatoren zur Reaktion
gebracht. Der entstehende Aldehyd ist um ein C-Atom länger als das eingesetzte Alken.

Allerdings darf die Temperatur nicht zu hoch sein, da sich dann auch Alkohole bilden können.
7 Darstellung von Aldehyden durch Addition von Sauerstoff an Alkene
Die Sauerstoffaddition an Alkenen erfordert die Anwesenheit von Katalysatoren. Die gängigsten sind
PdCl2 oder CuCl2. Diese Reaktion läuft relativ problemlos ab.
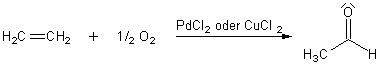
Weitere Texte zum Thema „Aldehyde und Ketone“