Schwefel in biochemischen Verbindungen
Experimente:
Versuch: Hepar-Probe
Versuch: Erhitzen von schwefelhaltigen biochemischen Substanzen
Versuchsgruppe: Wohlgerüche aus der Retorte: Maillard-Reaktionen
Die häufigsten Elemente, die in biochemischen Verbindungen vorkommen, sind
C, O, H, N, S, P
Besonders der Schwefel gilt als ein typisches "biologisches" Element. Man kann ihn deshalb in vielen natürlichen, organischen Materialien nachweisen. Hierzu gibt es die klassische Hepar-Probe (lat. hepar, Leber). Man nennt sie auch "Leberfleckprobe" (-> Versuch). Beim Abbau entstehen oftmals Schwefelwasserstoff (Geruch nach faulen Eiern) sowie Thiole. Diese Gase kann man deshalb leicht nachweisen, wenn man Biomasse vorsichtig erhitzt. Das funktioniert auch schon mit Aminosäuren wie Cystein, dem Medikament N-Acetylcystein (ACC) sowie dem Vitamin B1 (-> Versuch).
Zusammenstellung von exemplarischen biochemischen Verbindungen,
in denen Schwefel gebunden vorkommt.
Aminosäuren
Cystein, Cystin, Methionin
Enzyme
- Cystein im aktiven Zentrum von Papain (Proteinase aus der Papaya-Frucht)
- Cystin bzw. S-S-Brücken von RNAse (RNA-spaltende Hydrolase)
Zentrale Bindungsstellen in Multienzymkomplexen
Fettsäuresynthetase-Komplex
Thioester
Acetyl-CoA (aktive Essigsäure)
Vitamine
- B1 = Aneurin (Coenzym des Pyruvatdehydrogenase-Komplexes zum Schluss der Glykolyse)
- Biotin (Überträgt CO2-Moleküle bei der Fettsäuresynthese)
Peptidhormone
- Zwei S-S-Brücken im Molekül von Insulin verbinden die a- und die
b-Ketten
- Hormone der Hypophyse
Glutathion (GSH)
Tripeptid g-Glu-Cys-Gly, wichtig zur Entgiftung von PAK sowie als Cofaktor von
Peroxidasen
Schwefelcluster
Fotosynthese- sowie Nitrogenase-Komplexe
Sekundäre Pflanzenstoffe
Geruchsstoffe in Lilien (u. a. Spargel, Zwiebeln, Knoblauch), Buchsbaum, Schwarze Johannisbeere ("Cassis")
Sexuallockstoffe einiger Raubtiere
Geruchsstoffe von Mardern (u. a. vor allem Stinktier, Marderhund), Katzen
Geschmacksstoffe
Maillard-Stoffe, die beim Erhitzen von schwefelhaltigen Aminosäuren, Monosacchariden und Thiamin entstehen;
z. B. Geruch nach frisch geröstetem Kaffee oder gebratenem Fleisch (-> Versuch).
Schwefelsäureester (Sulfate)
Taurin (polarer Bestandteil von Gallensäuren)
Schleimbildner (Chondroitinsulfat und andere saure Mucopolysaccharide)
Wie der Schwefel in den Körper gelangt
Abgesehen von Nahrungsquellen, in denen Cystein oder Methionin sowie S-haltige Vitamine usw. vorhanden sind,
werden die allermeisten Schwefelverbindungen in unserem Körper ausgehend von Methionin synthetisiert.
Die Sulfat-Ionen bilden die Ausgangssubstanzen für die Schwefelsäureester. Das anorganische Sulfat-Ion ist
chemisch sehr inert und muss deshalb vor seiner Umformung aktiviert werden. Das ist sehr energieaufwendig. Dazu
sind drei enzymatisch katalysierte Reaktionen nötig.
|
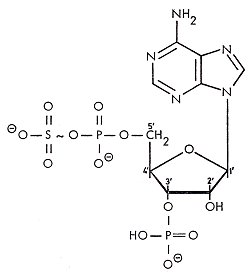
1. Herstellung eines gemischten Säure-Anhydrids (APS)
2. Hydrolyse von anorganischem Pyrophosphat zur Erhöhung der Energieausbeute bei der ATP-Spaltung
3. Zusätzliche Phosphorylierung des APS in 3´
|

Dieses aktivierte Sulfat kann weiter verarbeitet werden. Die Kopplung mit Phenolen spielt eine Rolle bei der Entgiftung von Aromaten.
Weitere Texte zum Thema „Schwefel“