

Wie die molekulare Struktur die Eigenschaften des Schwefels beeinflusst
Experimente:
Versuch: Schmelzen von Schwefel


Beide Bilder stellen reinen Schwefel dar. Was unterscheidet sie?
(Fotos: Daggi)
Chemiker unterscheiden und ordnen die vielen Stoffe unserer Welt entsprechend derer Eigenschaften.
Sie haben dabei gelernt, dass man den inneren Aufbau der Stoffe kennen muss, um die Stoffeigenschaften
zu verstehen. Denn die Eigenschaften der Stoffe sind die Folge ihres molekularen Aufbaus. Wenn wir
deren Aufbau kennen, können wir daraus auf ihre Eigenschaften schließen - und umgekehrt.
Ein schönes Beispiel, an dem du das selbst nachvollziehen kannst, ist der Schwefel (->
Versuch). Schwefel können wir schmelzen. Die
Schmelze ist zunächst hellgelb und flüssig wie Wasser. Mit steigender Temperatur
wird die Schmelze jedoch zunehmend dunkel und zähflüssig. Sie wird dabei so fest, dass du das
Reagenzglas auf den Kopf stellen kannst, ohne dass es ausläuft! Bei weiterem Erhitzen wird der
Schwefel wieder flüssig. Wenn wir diese Flüssigkeit ins Wasser gießen, bildet sich eine plastische
hellbraune Masse. Diese wird nach ein paar Stunden wieder fest und nach einigen Tagen wieder gelb:
Auch das muss Schwefel gewesen sein, plastischer Schwefel.
Wenn wir den Schwefel nicht ins Wasser gießen, beginnt er bei weiterem Erhitzen zu sieden. Es
bildet sich gelber Dampf, der ohne zunächst zu einer Flüssigkeit zu kondensieren
sofort gelben Feststoff bildet. Diesen Übergang vom dampfförmigen zum festen Aggregatzustand nennt
man (Re)Sublimation, den so gewonnenen Schwefel Schwefelblume.
Dieses Verhalten des Schwefels hat die Menschen vor allem zur Alchemistenzeit immer wieder fasziniert. Es hat lange gedauert, bis man die Abläufe verstanden hat. Dazu musste man erst einmal wissen, wie Schwefel aufgebaut ist.
Schwefelkristalle bestehen aus ordentlich gestapelten Schwefelatomen. Dabei sind immer acht Atome zu einem ringförmigen Molekül zusammengefasst. Schwefel hat also die chemische Formel S8.
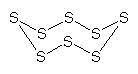
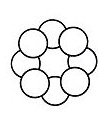
S8-Ring
Je nachdem, wie sich die "S8-Krönchen" anordnen, entsteht rhombischer oder monokliner Schwefel. Wir sprechen bei den verschiedenen Kristallformen von Modifikationen; das Verhalten ist die Allotropie.
Beim Schmelzen bleiben die Ringe zunächst erhalten. Mit zunehmender Wärmezufuhr werden die Ringe geöffnet. Tausende von geöffneten Ringen verbinden sich untereinander zu langen Ketten aus Schwefelatomen. Das erinnert daran, wie Kunststoffmonomere Makromoleküle bilden.
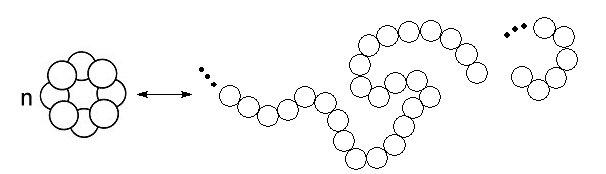
Diese Ketten verheddern sich untereinander, die Schmelze wird fest. Wenn wir allerdings noch stärker erhitzen, lösen sich die Ketten wieder voneinander - wie beim Schmelzen von Kunststoffen. Nun können wir die Schmelze in kaltes Wasser gießen. Durch das rasche Abkühlen frieren wir den kunststoffartigen Zustand regelrecht ein. Wir haben plastischen Schwefel hergestellt. Aus dem bildet sich in der Kälte langsam wieder normaler Schwefel, indem sich die S8-Ringe zurückbilden.
Die schwarzrote Farbe der Schwefelschmelze resultiert aus der Vielfalt von Elektronen-Zuständen auch über viele Schwefelatome hinweg, die bewirken, dass das gesamte einfallende Licht absorbiert wird.
Beim Sieden zersetzen sich die Ketten. Es dampfen zunächst erst einmal S2-Moleküle ab, die sich dann beim Abkühlen wieder zu S8-Ringen, aus denen der feste Schwefel besteht, zusammenlagern. Damit hat sich der Kreis wieder geschlossen.
Weitere Texte zum Thema „Schwefel“