 |
| Bild 1: Rhombischer Schwefel
(Foto: Blume) |
Modifikationen
Experimente:
Versuch: Modifikationen des kristallinen Schwefels
Versuch: Vergleich der Modifikationen des Kohlenstoffs
 |
| Bild 1: Rhombischer Schwefel
(Foto: Blume) |
Normaler Schwefel besteht aus achtatomigen
Molekülen: S8. Es handelt sich um gewellte Ringe mit typischer Kronenform.
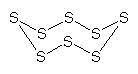  |
Folglich baut Schwefel seine Kristalle auf, indem er Molekülgitter aus S8-Einheiten bildet. Die Ringe sind untereinander nur locker durch van der Waals-Kräfte verbunden. Das ist der Grund dafür, weshalb Schwefelkristalle schon bei niedrigen Temperaturen schmelzen und warum sie auch nicht sonderlich stabil sind.
Es gibt beim Schwefel zwei Kristallarten, die unterschiedlichen Kristallsystemen angehören. Die erste Form ist rhombisch. Man erkennt Doppelpyramiden, denen häufig noch die Spitzen fehlen (-> Bild 1 und Bild 4). Die zweite Form gehört zum monoklinen Kristallsystem. Sie bildet nadelförmige Prismen.
Diese Kristallformen kannst du selbst leicht herstellen (-> Versuch):
- Rhombischer Schwefel kristallisiert aus seiner Lösung in Schwefelkohlenstoff.
- Monoklinen Schwefel erhältst du, wenn eine Schwefelschmelze rasch abkühlt und auskristallisiert.
 |
| Bild 2: Rhombischer Schwefel in einer Kristallisierschale
(Foto: Daggi) |
 |
| Bild 3: Monokliner Schwefel im Schmelztopf
(Foto: Blume) |
Tritt wie der Schwefel ein Stoff in zwei Kristallsystemen auf, so
sprechen wir von Modifikationen.
Diese haben, obwohl sie nur aus einem Stoff bestehen, signifikant unterschiedliche
Eigenschaften. Das betrifft vor allem physikalische Eigenschaften wie z. B. den Schmelzpunkt
und die Löslichkeit. Grund hierfür ist der Energieunterschied zwischen den beiden
Elementarzellen. Folglich bestimmt die Temperatur darüber, welche Modifikation sich bildet
und welche stabil ist. Beim Schwefel bildet sich unterhalb von
95,6 °C die rhombische Form, oberhalb die monokline.
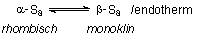
Das rhombische Gitter hat einen niedrigeren Energiegehalt als das monokline. Deshalb ist das rhombische Gitter unterhalb der Umwandlungstemperatur stabil, das monokline darüber. Kühlt man monokline Kristalle ab, so zerfallen die Nadeln (wenn auch langsam) unter Bildung von rhombischen Dipyramiden. Bild 4 zeigt eine abgekühlte Schmelze von Schwefel, die über Monate hinweg aus einer Vielzahl von monoklinen Kristallen sogar einen großen Rhombus gebildet hat.
 |
| Bild 4: Umwandlung von monoklinen in
rhombischen Schwefel. Links ein Schwefelrhombus zum Vergleich
(Foto: Daggi) |
Modifikationen beobachten wir auch bei vielen anderen Stoffen. Beispiele sind der
Kohlenstoff, das Zinn oder
das Siliciumdioxid. Bekannt sind auch die beiden Modifikationen
von Calciumcarbonat. Zunächst bildet sich der
rhombische Aragonit, der sich dann in den trigonalen (rhomboedrischen) Calcit
umwandelt. Aragonit entsteht auch bei der Biomineralisation durch
Muscheln oder Schnecken.
Unterschiedliche Kristallklassen sind keine Modifikationen!
Allerdings muss man beachten, dass unterschiedliche Kristallformen noch keine
Modifikationen sein müssen. Das ist der Fall, wenn es sich um Kristallklassen
im gleichen Kristallsystem handelt.
Beispielsweise tritt der Diamant in den Formen Tetraeder, Oktaeder,
Würfel und abgestumpfter Würfel auf. Das sind aber nicht etwa Modifikationen des
Diamants, denn die Grundform ist und bleibt das kubische System mit seiner rechtwinkligen,
gleichseitigen Elementarzelle. Nur äußere Bedingungen haben den Kristall
veranlasst, aus der hochsymmetrischen, würfelförmigen kubischen Elementarzelle
diese oder jene Wachstumsrichtung einzuschlagen. Dagegen sind Graphit, Diamant und Fulleren
echte Modifikationen des Kohlenstoffs mit bemerkenswerten
Unterschieden in ihren physikalischen Eigenschaften. Das betrifft unter anderem auch ihre
Kristallklassen und Gitterkonstruktion.
Ein anderes bekanntes Beispiel für Modifikationsbildung sind die Mineralien mit der chemischen Zusammensetzung Eisendisulfid FeS2. Man findet sie als Pyrit und Markasit. Pyrit kristallisiert kubisch, Markasit rhombisch.

Pyrit |

Markasit |
| Bild 5 (Fotos: Blume) |
Beim Pyrit findet man dazu noch fast alle kubischen Kristallklassen, die wiederum keine
Modifikationen sind: Es gibt Würfel, abgestumpfte Würfel, Tetraeder, Oktaeder,
Pentagondodekaeder, Rhombendodekaeder, Ikosaeder und viele, viele mehr.
Pyritkristalle sind stabil. Dagegen ist der chemisch gleich zusammengesetzte Markasit eine
instabile FeS2-Modifikation. Aus ihr entsteht in exothermer Reaktion Pyrit.
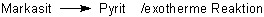
Das Markasit-Gitter hat eine höhere Energie und ist deswegen instabil; es wird schon
durch Sauerstoff, Wasser und sogar durch Bakterien angegriffen. Steinesammler wissen, dass
so manche schöne Sammlungsstücke deswegen einfach zerfallen.
Übrigens behält der gebildete Pyrit oftmals die Form des ursprünglichen
Markasitkristalls bei. Es hat nur eine Gitterumlagerung, die die Elementarzelle betrifft,
stattgefunden. Das sind dann die "stabilen Markasitstücke", die man häufig in Ton-Gesteinen
findet. Hierzu gehören z. B. die prächtigen Markasit-Sonnen und viele
Versteinerungen ("Goldschnecken"). Zur Unterscheidung hilft neben der Beobachtung der
Stabilität nur ein Blick ins Kristallgitter.
 |
| Bild 6: Pyrit-Ammonit (Kosmoceras ornatus;
Dogger, Schwäbische Alb)
(Foto: Blume) |
Ob es sich nun beim Fundstück um stabiles Pyrit oder instabiles Markasit handelt, kann
man erst nach einigen Jahren beurteilen. Sieht der Ammonit oben dann wie im folgenden Bild aus,
so war er aus Markasit "gefertigt".
 |
| Bild 7: Zerfallener Markasit-Ammonit (Kosmoceras ornatus;
Dogger, Schwäbische Alb)
(Foto: Blume) |
Weitere Texte zum Thema „Kristalle“