Prof. Blumes Tipp des Monats April 2005 (Tipp-Nr. 94)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemische Pop-Art - Spielerei mit Indikatoren
Mit der Chemie lässt sich auch im künstlerischen Bereich Treffliches
erschaffen. Nur schade, dass manches Schöne und Beeindruckende davon
vergänglich ist - so wie die folgenden Bilder.
Für euch und eure LehrerInnen ein Tipp im Tipp: Das wäre doch einmal ein Thema
für ein Projekt wie zum Beispiel "Chemie und Kunst"...
|
Versuch 1: Gelbe Linien in blauer Lösung
|


Bild 1 (Fotos: Daggi)
Wir sehen, dass sich die gelben Linien ausdehnen und in der Lösung merkwürdige
Gebilde entstehen. Dabei ist alles in ständiger Bewegung.
Wir können das Ganze auch umkehren.
|
Versuch 2: Blaue Linien in gelber Lösung
|


Bild 2 (Fotos: Daggi)
Die folgende Bilderreihe zeigt, wie sich die blauen Linien entwickeln.
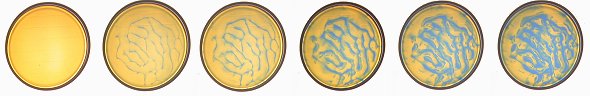
Bild 3 (Fotos: Daggi)
Wenn wir uns das Ganze in der Projektion angeschaut haben, sollten wir das auch
einmal aus der Nähe betrachten: Wir sehen, dass die Linien auch in der Flüssigkeit
merkwürdige dreidimensionale Strukturen bilden. Dazu können wir auch eine Schale
nehmen, in der die Schichtdicke der Lösung größer ist.
Was steckt chemisch dahinter?
Es handelt sich um die bekannten Indikatorreaktionen, die auf der Veränderung
des pH-Werts der Lösungen beruhen. Hier geht es dazu noch um die Löslichkeit
von gasförmigen Säure- und Base-Anhydriden.
Konzentrierte Salzsäure zum Beispiel dampft Chlorwasserstoff HCl ab, der rasch in
das Wasser eindringt. Bekanntlich ist HCl-Gas sehr gut in Wasser löslich: Bei
20 °C beträgt seine Löslichkeit 500 L Gas / L Wasser.
Nun sollte man erwarten, dass die ganze Oberfläche mit HCl-Gas gesättigt wird.
Das ist offensichtlich nicht der Fall. Es werden die Stellen bevorzugt, bei
denen die Lösung zuerst Kontakt mit den HCl-Dämpfen hatte. Von da aus entwickeln
sich die Linien. Die Ursache hierfür ist an diesen Stellen eine punktuelle Veränderung
der Oberflächenspannung des Wassers, die den weiteren Zustrom von HCl-Gas
erleichtert / fördert.
Das Gleiche beobachtet man mit konzentrierter Ammoniaklösung. Das entweichende NH3-Gas ist in Wasser sehr gut löslich: In einem Liter Wasser "verschwinden" bei 0 °C 1176 Liter Ammoniak, bei 20 °C 702 Liter des Gases.
Zwar meint man immer, dass aufgrund des Umklapp-Mechanismus der Wasserstoffbrücken in Wasser Neutralisationsreaktionen sehr rasch durch das ganze Gefäß verlaufen müssten. Aber es gibt da offensichtlich doch Grenzen, wie in diesen Experimenten deutlich wird. Wasser ist in sich nicht so einheitlich strukturiert, wie man immer meint.
Diese Experimente solltet ihr mit allen möglichen Indikatoren
aus eurer Chemie-Sammlung durchprobieren
Die folgenden Bilder zeigen den Versuch mit Phenolphthaleinlösung, die zuvor
mit ein-zwei Tropfen (nicht mehr!) Natronlauge (C) purpurn eingefärbt wurde.


Bild 4 (Fotos: Daggi)
Hier sieht man die zeitliche Entwicklung des Bildes.

Bild 5 (Fotos: Daggi)
Beim Phenolphthalein ist der umgekehrte Vorgang nicht so deutlich, da sich die
gesamte Lösung beim Kontakt mit NH3-Gas sofort rosa färbt.
Ihr seht - eurer Gestaltungsfreude sind keine Grenzen gesetzt. Dabei könnt ihr auch viel über Indikatoren lernen. Zum Beispiel gelingt die Bildergestaltung nicht mit allen Indikatoren. Die haben nämlich bestimmte Farbumschlagbereiche. Die Natur ist gegen die Kreativität.
Wenn ihr eine schöne Art-Galerie zusammengestellt habt, könnt ihr die ja als Projektergebnis euren Eltern vorstellen!
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 09. Juni 2010, Dagmar Wiechoczek