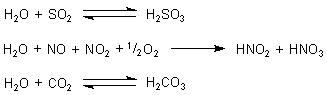
Gelöste Gase
Experimente:
Versuch: Luft löst sich in Wasser
Versuch: Änderung der elektrischen Leitfähigkeit beim Einleiten von
CO2 in Wasser
Versuch: Der Springbrunnenversuch
Ohne Sauerstoff kein höheres Leben im Wasser
Sauerstoff und Stickstoff liegen in der Luft im Verhältnis von 1:4 vor. In Wasser
dagegen ist Sauerstoff stark angereichert. Hier liegt das Verhältnis von O : N bei 1 : 1,8.
Genau: Bei 0 °C lösen sich in 1 Liter Wasser 10,3 ml O2 und 18,1 ml N2.
Das ist für das Leben im Wasser wichtig. Dabei hängt die Löslichkeit der Gase noch
von der Temperatur ab:
| Löslichkeit von Sauerstoff in Wasser | |
| Temperatur (°C) | Gasmenge (mg/l) |
| 0 | 14,16 |
| 10 | 10,92 |
| 20 | 8,84 |
| 30 | 7,53 |
| 40 | 6,59 |
Die Abhängigkeit der gelösten Gasmenge von der Temperatur ist für Wärmekraftwerke, die ihr Kühlwasser an Flüsse abgeben, wichtig. Sie heizen bei ungenügender Abkühlung mit dem Abwasser die Flüsse auf und beeinflussen dadurch die Sauerstoffbilanz. Sie bedrohen damit aber auch das tierische Leben im Wasser. Allerdings gibt es bei den Fischen in der Empfindlichkeit bezüglich Sauerstoffmangel große Unterschiede; Extreme bilden Forelle und Aal.
Manche Gase sind Säureanhydride
Während sich die beiden bislang besprochenen Gase in Wasser nur lösen, reagieren andere
Gase darüber hinaus noch mit dem Wasser zu chemischen Verbindungen. Chlorwasserstoff HCl,
der sich bei Verbrennung von PVC bildet, reagiert zur starken Salzsäure. Da sind weiter
die Säureanhydride wie Schwefeldioxid SO2, die reaktiven Stickoxide NO und NO2
("NOx") und vor allem das Kohlenstoffdioxid CO2:
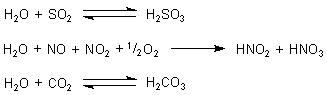
Alle diese Reaktionen sind exotherm. Deshalb wird die Löslichkeit der Gase durch Abkühlen gefördert.
Die Säuren finden sich im Sauren Regen oder im
Oberflächenwasser. Ihre Bildungsgleichgewichte werden durch Protonenabspaltung verschoben; denn
die entstehenden Anionen sind stabiler als ihre Säuren.
Die besondere Rolle des CO2
Die folgende Tabelle zeigt die Temperaturabhängigkeit der Löslichkeit von CO2 in einem
Liter Wasser (Druck 1,031 bar).
| Löslichkeit von CO2 in Wasser | |
| Temperatur (°C) | Gasmenge (L) |
| 0 | 1,658 |
| 10 | 1,159 |
| 20 | 0,851 |
| 30 | 0,646 |
| 40 | 0,516 |
| 50 | 0,423 |
| 60 | 0,353 |
| 70 | 0,300 |
Das im Meer gelöste CO2 ist besonders wichtig für die CO2-Bilanz der
Atmosphäre. Es spielt bei den Treibhausszenarien eine wichtige Rolle. Momentan scheint sich noch
genügend CO2 im Meer zu binden, vor allem auch, weil die Meeresorganismen
das CO2 in der Form des Hydrogencarbonats zum Aufbau von Carbonat-Schalen oder zur
Fotosynthese verwenden.
Wenn es jedoch wärmer wird, ist die Grenze der Löslichkeit irgendwann erreicht, dann wird
das Gas wieder frei gesetzt. Dadurch heizt sich die Atmosphäre noch rascher auf, das wiederum
erwärmt die Meere noch mehr... Hier sprechen wir von einem Autozyklus.
Auch manche Basen lösen sich im Wasser
In Wasser lösen sich bestimmte Basen, die mit Wasser Laugen bilden. Dazu gehören Ammoniak
und Amine.

Das ist wichtig für die Abwässer von Bauernhöfen und Viehzucht-Großbetrieben. Das Ammoniak wird bakteriell zu Nitrit und Nitrat mineralisiert.
Chemische Springbrunnen
Einige Gase wie Ammoniak lösen
sich sehr gut in Wasser. So löst 1 l Wasser bei 0 °C 1176 Liter Ammoniak, bei 20 °C 702 l des Gases!
In einem geschlossenen Raum bildet sich bei Kontakt des Gases mit etwas Wasser rasch ein Vakuum.
Darauf beruht die Funktion des chemischen Springbrunnens (-> Versuch).
Eine Versuchsvariante dazu stellen wir in unserer Webseitensammlung
"Tipp des Monats" vor.
 |
| (Foto: Daggi) |
Weitere Texte zum Thema „Wasser“