Prof. Blumes Tipp des Monats April 2009 (Tipp-Nr. 142)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Magnesium als Klimaschutzmittel?
Es wird viel darüber nachgedacht, wie man das klimaschädliche CO2 aus der Atmosphäre holen könnte. Viele Erfinder vom Kaliber eines Daniel Düsentrieb machen sich da so ihre Gedanken. Echt genial ist der oft gehörte Einfall, CO2 in Kalkwasser zu leiten und den ausgefällten Kalk zu deponieren: Denn Kalkwasser stellt man bekanntlich her, indem man gebrannten Kalk in Wasser gibt. Und gebrannten Kalk gewinnt man durch energieaufwändiges Brennen von Kalkstein (CaCO3).
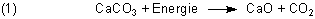
Über die Bilanz dieses Verfahrens kann man ja mal eine Facharbeit schreiben lassen…
Das ebenfalls in Erwägung gezogene schlichte Auswaschen von CO2 aus der Luft besorgen bislang noch die Ozeane. Seriöser ist deshalb die Idee, CO2 durch Abkühlen der Luft auszufrieren.
Was jedoch macht man dann mit dem so abgetrennten CO2? Man kann es deponieren - zum Beispiel in unterirdischen Kavernen (Bergwerken oder ausgebeuteten Salzlagern). Damit jedoch verschiebt man nur das eigentliche Problem auf später - wie bei der Entsorgung von „Atommüll“.
So hat mich jemand ernsthaft gefragt: „Wie wäre es, wenn man das abgetrennte CO2 reduzieren täte - zum Beispiel zu unschädlichem Kohlenstoff?“
Das geht - aber nur mit starken Reduktionsmitteln. Ein denkbares wäre Magnesium.
|
Versuch 1: Reduktion von CO2 mit Magnesium
Nicht in die gleißendhelle Flamme schauen! Sonnenbrille aufsetzen! Anschließend hält man das brennende Bandbüschel in den Zylinder und verschließt diesen wieder so gut es geht, damit von außen möglichst wenig Luft nachströmen kann. Man achtet darauf, dass das brennende Band ab und zu die Glaswand berührt. Damit schreckt man die Flamme ab. Ergebnis:
Diese Ablagerungen untersuchen wir. Vom frischen weißen Pulver geben wir eine Probe in Wasser, das etwas
Phenolphthaleinlösung enthält: Das Wasser färbt sich rosa.
|

Bild 1: Ergebnis von Versuch 1. Man erkennt die Rußablagerungen an der Glaswand
(Foto: Daggi)
Offenbar hat das Magnesium mit dem CO2 reagiert. Das unruhige und geräuschvolle Brennen der Flamme
nennt man „Spratzen“. Das kommt daher, dass die Prozesse an der Oberfläche ablaufen. Die setzt sich zu; es sollte zu einem
Stillstand der Reaktion kommen. Durch die Hitze wird das Metall jedoch geschmolzen und fließt unter der „Oxidrinde“. So
wird immer wieder neue Oberfläche geschaffen. Das Metall kann wieder oxidiert werden - und so weiter. Insgesamt
kommt es so zum „Spratzen“. Leider hat das aber auch zur Folge, dass die Flamme verlöschen kann. Dann muss man sie
wieder entzünden.
Nun zu den chemischen Abläufen. Das weiße Pulver ist Magnesiumoxid MgO, der schwarze Rückstand, der beim Abschrecken der Flamme an der Glaswand entstanden ist, ist Kohlenstoff. Somit können wir die Reaktion mit der folgenden Gleichung beschreiben.
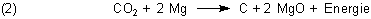
Zu den Nachweisen: Frisch gefälltes MgO bildet mit Wasser eine Lauge. Diese enthält Hydroxid-Ionen, welche bewirken, dass sich die Phenolphthaleinlösung rosa färbt.
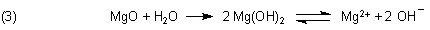
MgO zersetzt sich deshalb auch leicht in Salzsäure. Es bildet sich leicht lösliches Magnesiumchlorid.
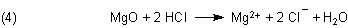
Zurück bleibt der schwarze Kohlenstoff, den wir wieder zu CO2 verbrennen können.
Fazit: Magnesium hat tatsächlich dem Kohlenstoff seinen Sauerstoff entrissen.
Man muss übrigens davon ausgehen, dass sich nicht nur Kohlenstoff gebildet hat, sondern dass auch Magnesiumcarbide entstanden sind. Das wollen wir hier aber nicht weiter berücksichtigen.
Ist die Reaktion energetisch überhaupt möglich?
Das geht nur, wenn die Oxidationsenergie des Magnesiums größer ist als die des Kohlenstoffs. Dafür spricht,
dass die Reaktion zwischen Magnesium und CO2 deutlich exotherm ist.
Um den Wert der Reaktionswärme zu ermitteln, müssen wir zunächst die Oxidationen der Reaktionspartner getrennt betrachten. Da wir bei konstantem Druck gearbeitet haben, sprechen wir besser von der Reaktionsenthalpie. Dabei müssen wir auch noch beachten, dass die Reaktionsenthalpie von der Menge der umgesetzten Stoffe abhängt. In den folgenden Gleichungen beziehen wir die Enthalpie auf 1 Mol des oxidierten Elements (kJ/mol). Deshalb benutzen wir in Gleichung (5b) auch die umstrittene Schreibweise ½ O2.
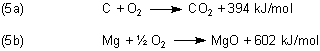
Es ist für viele Leute überraschend, dass bei der Oxidation von Kohlenstoff nur halb so viel Wärme freigesetzt wird wie bei Magnesium.
Wenn wir die Reaktionsenthalpie für die Reaktion (2) ausrechnen wollen, müssen wir die Gleichungen (5a) und (5b) kombinieren. Dazu sind die Gleichungen etwas zu verändern. Zunächst stellen wir die Gleichung (5a) so um, dass sie jetzt einen endothermen Prozess beschreibt. Denn die Reduktion von CO2 ist ein Prozess, der Energie verbraucht. Außerdem multiplizieren wir (5b) mit 2, da wir ja pro Mol CO2 zwei Mol Magnesium benötigen. Dann haben wir aber auch die doppelte Enthalpie. Die definieren wir als kJ/Formelumsatz.
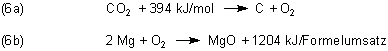
Diese beiden Gleichungen addieren wir.
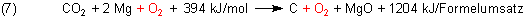
Dabei gehen wir wie beim Bearbeiten einer mathematischen Gleichung vor. Das Symbol O2 für Sauerstoff tritt in Gleichung (7) links und rechts auf; deshalb können wir es eliminieren. Entsprechend mathematisch behandeln wir auch die Energiewerte. Es resultiert die Gleichung (8), die der Gleichung (2) entspricht.
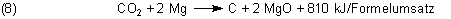
Die Reaktionsenthalpie für den Formelumsatz in Gleichung (2) beträgt also 810 kJ. Vergleichen wir diesen Wert mit der Reaktionsenthalpie in Gleichung (6b), so fällt auf, dass der Wert in (8) deutlich kleiner ist. Das ist nicht weiter verwunderlich, da der Sauerstoff von vornherein gebunden vorliegt und Energie aufzuwenden ist, um ihn dem Kohlenstoff zu entreißen.
Wenn die Energie so hoch ist: Können wir mit Magnesium auch Carbonate
zersetzen?
Auch das ist möglich. So kann man aus schneeweißem Marmor (reines Calciumcarbonat CaCO3) schwarzen
Kohlenstoff zaubern.
|
Versuch 2: Magnesium reagiert mit Marmor
Nicht in die gleißendhelle Flamme schauen! Sonnenbrille aufsetzen! Ergebnis:
|
 |
| Bild 2: Versuch 2 - vorher und nachher (Fotos: Daggi)
Hierzu gibt es einen Film (19 MB) Klicke hier |
Die Reaktionsgleichung ist:
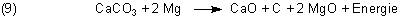
Die Reaktion wird wohl so ablaufen, dass durch die Hitze des brennenden Magnesiums das Calciumcarbonat wie beim Kalkbrennen in CaO und CO2 gespalten wird (-> Gleichung (1)). Das freigesetzte CO2 reagiert wie in Gleichung (2) beschrieben weiter.
Magnesium als Klimaschutzmittel?
Stellen Sie sich vor: Durch Reduktion mit Magnesium könnte man nach Gleichung (8) letztlich nicht nur CO2
der Atmosphäre entziehen, sondern auch den Kohlenstoff recyceln und erneut zum Verbrennen nutzen. Da bei dieser Rückgewinnung
nach Gleichung (8) sogar noch Wärme frei wird, könnte man zusätzliche Energie gewinnen.
Ist das etwa ein Perpetuum Mobile, also ein Vorgang, der abläuft, ohne Energie zu verbrauchen, und der dabei sogar noch Energie erzeugt?
Nein! Denn überlegen wir einmal, welchen energetischen Aufwand es allein bedarf, um Magnesium durch Elektrolyse aus den Schmelzen seiner Salze zu gewinnen!
Mit Magnesium gegen CO2, den Klimakiller Nummer 1, angehen zu wollen, ist deshalb eine Schnapsidee - eben ein echter Aprilscherz.
Last but not least
Der Ehrlichkeit halber muss gesagt werden, dass es mittlerweile katalytische Verfahren gibt, um CO2
mit Wasserstoff zu reduzieren, wobei Kohlenwasserstoffe entstehen. Aber dazu sind sehr hoher Druck und hohe
Temperaturen notwendig, so dass die Bereitstellung der Energie für diese Verfahren insgesamt wohl mehr CO2
freisetzt als umgesetzt wird.
Es sei denn, man setzt auf Atomenergie…
Rüdiger Blume
Weitere Tipps zur Reaktivität des Magnesiums
Spektakulär: Magnesium reduziert Quarz
Der nichtrostende Eisennagel oder die Opferanode
Chemie mit dem Bleistiftanspitzer
Erhellendes um das Blitzlicht
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 25. März 2010, Dagmar Wiechoczek