Prof. Blumes Tipp des Monats August 2000 (Tipp-Nr. 38)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

(Foto: Rosi Raimund)
Für Aquarienfreunde: Aufhärten von Wasser
Neuerdings stellt sich öfter das Problem, dass man aus gesundheitlichen Gründen Wasser aufhärten will. Vielleicht ist das auch für Aquarienbetreiber notwendig. Nun gibt es offenbar irgendwo den Ratschlag, dass man dazu Natriumhydrogencarbonat nehmen soll. So erhielten wir vor kurzem die folgende Anfrage:
Hallo,
Ich bin auf der Suche nach einem Hinweis, wie Natriumhydrogencarbonat am besten
in wässrige Lösung gebracht werden kann und wie diese stabil bleibt. Ich brauche
diese Information, um Wasser von 11 °dH auf etwa 18 °dH aufzuhärten. Die Norm
dazu ist mir zwar bekannt, aber die Löslichkeitsversuche lassen zu wünschen übrig
(Salz setzt sich immer wieder ab). Für ein paar Tips wäre ich Ihnen sehr dankbar.
Mit freundlichen Grüßen
R. S.
Nicht jedes Hydrogencarbonat ist zum Aufhärten geeignet!
Wasserhärte ist nicht ausschließlich auf die Anwesenheit
von Hydrogencarbonat-Ionen zurückzuführen, sondern auf gelöste Calcium- und
Magnesium-Ionen. Was sich da bei Herrn S. nach Zugabe von
Natriumhydrogencarbonat absetzt, ist nicht dieses Salz, sondern schlicht Kalkstein
(und natürlich auch Magnesiumcarbonat etc.). Denn durch Zugabe von NaHCO3 setzt
man die Härte des Wassers sogar herunter. Grund: HCO3--Ionen stehen im
Gleichgewicht mit (wenn auch wenig) Carbonat-Ionen CO32-. Diese bilden
schwerlösliches Calciumcarbonat. Damit verschwinden Ca-Ionen aus der
Lösung. Man kann auch sagen, dass man durch Zusatz von Natriumhydrogencarbonat das folgende
Gleichgewicht nach rechts verschiebt:
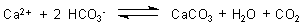
(Aufgrund dieser Reaktion bilden sich beim Abkochen von hartem Wasser auch die bekannten
Kalkablagerungen.) Gleiches beobachtet man (wenn auch effektiver), wenn man Soda zusetzt.
Hierbei reduziert man die Wasserhärte um etwa 50 %, also um den
Anteil der temporären Härte.
Man muss statt Natrium- das Calciumhydrogencarbonat nehmen. Dieses ist leicht
löslich und verändert die Gesamt-Härtebedingungen nicht, so dass nichts ausfällt. Da
man an dieses Salz wohl kaum herankommt, sollte man sein aufzuhärtendes Wasser
mit Gerolsteiner Sprudel mischen. Dessen Härte beträgt, wie man leicht ausrechnen
und auch messen kann, 73,46 °dH. Man kann natürlich auch ein anderes
Mineralwasser nehmen; dieses muss aber überdurchschnittlich viel an Ca- und Mg-Ionen enthalten.
Zur Berechnung der Wasserhärte von Mineralwasser siehe unsere
Webseite.
Wie viel Mineralwasser muss man zugeben?
Die Rechnung ist einfach: Nehmen wir an, Sie haben 1 L Wasser mit der Härte
H1 und wollen diese auf H2 bringen. Wie viel
(a) ml Gerolsteiner mit der
Härte HM müssen Sie zugeben?
1000 mL · H1 + a mL · HM = (1000 mL + a mL) · H2
a = 1000 · (H2 - H1) / (HM - H2) mL
Im konkreten Fall folgt daraus mit H1 = 11 °dH, H2 = 18° dH und HM = 73,46 °dH:
a = 126,2 mL
Soviel Gerolsteiner müssen Sie zu 1 L Ihres Wassers der Härte 11 °dH geben, um 18 °dH zu erreichen. Dabei fällt auch nichts aus.
|
Versuch: Aufhärten von Wasser Schülerversuch; 20 min. Aufgabe
Geräte und Chemikalien
Durchführung
|
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek