Prof. Blumes Tipp des Monats September 2004 (Tipp-Nr. 87)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Coffein (Koffein) macht müde Menschen munter
Achtung: Coffein ist in größeren Mengen giftig!
Gleich vorneweg zur Schreibweise: Die Chemiker schreiben das Wort mit C, also "Coffein", während die Normalbürger die Schreibweise "Koffein" benutzen. Bei Internet-Recherchen sollte man deshalb beide Schreibweisen abfragen! Auf Englisch heißt es "caffeine".
Coffein hat die Summenformel C8H10N402. Diese Formel gibt nur Aufschluss über die elementare Zusammensetzung. Viel informativer und dazu noch optisch ansprechender ist die Anordnung der Atome im Molekül, die die Strukturformel zeigt
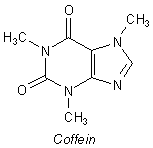
Die chemische Bezeichnung für Coffein ist 1,3,7-Trimethyl-xanthin. Xanthin ist ein sauerstoffhaltiges Purin-Derivat und somit mit den Purin-Basen der Nucleinsäuren verwandt. (Zur Darstellung der Strukturformeln klicke hier.)
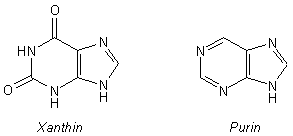
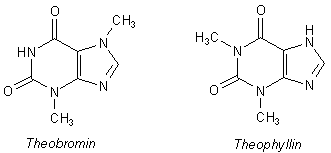
Es gibt noch zwei weitere, geringer methylierte Analoge zum Coffein, das Theobromin (3,7-Dimethyl-xanthin) und das Theophyllin (1,3-Dimethyl-xanthin):
Coffein ist bekanntlich eine Substanz biologischen Ursprungs und kommt in vielen verschiedenen Pflanzen vor. Am meisten ist es im Tee enthalten (4-5 Gew% Trockensubstanz). Im Kaffee ist es mit 0,9-2,6 Gew% zu finden. (Daher stammt schließlich auch die Bezeichnung der Substanz. Der Name Kaffee kommt übrigens vom türkischen kahve, das letztlich seinen Ursprung im Äthiopischen hat. Hier gibt es im Süden ein Gebiet, das bis heute "Kaffa" heißt, und in dessen wenigen wilden Wäldern auch noch tatsächlich der wilde Kaffee wächst und geerntet wird.) Weitere Pflanzen, in denen es im größeren Umfang zu finden ist, sind der Kolastrauch und der Kakaobaum.
Isolierung von Coffein
Es gibt zur Isolierung der Substanz Versuchsanleitungen, die darauf beruhen,
dass Coffein bei 180 °C sublimiert. Man soll demnach Teeblätter oder
Kaffeepulver in einer Sublimationsvorrichtung erhitzen. Diese Versuche führen
im Allgemeinen nur zur unappetitlichen Teerbildung.
Wir machen es stattdessen wie die richtigen Kaffee- oder Teetrinker: Wir extrahieren
die Teeblätter oder Kaffeebohnen mit einem Lösemittel. So hat es auch um 1821
der Chemiker Runge gemacht, der das Coffein entdeckt hat. Er nannte es übrigens
Kaffein.
Die größte Menge an Coffein ist in den Teeblättern enthalten.
|
Versuch 1: Isolierung von Coffein aus schwarzem Tee
|
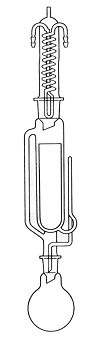
Bild 1: Soxhlet-Apparatur
Der alkoholische Auszug enthält neben Coffein auch mit herausgelöste Fette, Amine,
etherische Öle und Gerbstoffe. Um zunächst die Fette zu beseitigen, wird die Lösung mit
Magnesiumoxid behandelt. Durch dessen alkalische Reaktion werden die Fette
verseift und die Fettsäuren in die schwerlöslichen Magnesiumsalze überführt.
Danach wird die Probe mit Schwefelsäure und Chloroform behandelt; die Amine
bilden mit der Schwefelsäure wasserlösliche Salze, die in der wässrigen Phase
zurückbleiben. Die Tannine (Gerbstoffe) bilden als Phenolderivate mit Natronlauge
wasserlösliche Salze.
|
Versuch 2: Abtrennung der Verunreinigungen
2 Die vereinigten Filtrate werden mit 25 ml Schwefelsäure (c = 1 mol/l) (Xi) versetzt und am Rotationsverdampfer im Wasserstrahlvakuum auf 1/3 des Volumens eingeengt. Falls sich dabei ein flockiger Niederschlag abscheidet, wird dieser ebenfalls in der Hitze mit abfiltriert. 3 Man lässt die klare Lösung auf Raumtemperatur abkühlen und extrahiert sie fünfmal
mit je 20 ml Chloroform. Die vereinigten Chloroformextrakte werden im Scheidetrichter zunächst mit 10 ml
Natronlauge (c = 2 mol/l) (C), dann mit 10 ml Wasser geschüttelt. Die unten befindliche organische
Phase wird schließlich abgetrennt, zur Trockne eingedampft (am besten am Rotationsverdampfer).
|


Bild 2: Kristalle von Coffein
(Links erhalten durch Sublimation, rechts durch Umkristallisation
(Rechts: Coffeinkristalle am Glasboden, von außen fotografiert. Isoliert von Denitsa Gandeva und Maeve Melzer)
(Fotos: Daggi)
Man muss ein verschlossenes Röhrchen nehmen, da Coffein bei 180 °C sublimiert. Die Sublimation von Coffein ist übrigens
eine effektive Reinigungsmethode.
|
Versuch 3: Sublimation von Coffein
2 Wir können auch professioneller vorgehen: In ein großes Reagenzglas hängen wir ein kleineres
Glas, indem wir es durch einen durchbohrten Stopfen oder durch einen Nutschenring fixieren. Der Boden des kleinen
Glases darf nicht zu tief hängen! In das kleine Glas füllen wir kaltes Wasser.
|

Bild 3: Sublimation von Coffein
(Foto: Daggi)
Zur Überprüfung der Reinheit unseres so hergestellten Coffeins wenden wir die Dünnschicht-Chromatographie
(DC) an. Es ist gut, wenn man zur Identifizierung den Reinstoff als Vergleichssubstanz zur Verfügung hat.
Man erhält ihn bei der Firma Merck.
So kann man das Coffein auch in Medikamenten wie (z. B. Vivimed®) nachweisen.
|
Versuch 4: Dünnschicht-Chromatographie (DC) von Coffein
|

Bild 4: DC-Trennung Coffein unter UV-Strahlung
1: Coffein von Merck, 2: Nach Versuch 1-3 isoliertes Coffein
(Foto: Daggi)
Genaue Informationen über die Struktur gibt uns das Infrarotspektrum.
Wie stellt man koffeinfreien Kaffee her?
Da, wie wir noch sehen werden, Coffein physiologisch hoch aktiv ist und deshalb von vielen Menschen
nicht vertragen wird, bemüht man sich, das Gift aus dem ansonsten gern genossenen Kaffee zu entfernen.
Das machte man früher zunächst mit Benzol, dann mit chlorierten Kohlenwasserstoffen wie Chloroform,
Dichlormethan oder Tetrachlorkohlenstoff, was den Kaffee insgesamt für empfindliche Nasen ungenießbar
machte. Die Lösemittelrückstände waren auch ungesund.
1964 meldete K. Zosel vom Max Planck-Institut für Kohleforschung in Mülheim ein Patent zu einem Verfahren zur Hochdruckextraktion an, bei dem als Extraktionsmittel überkritisches Kohlenstoffdioxid genutzt wird. Dieses Verfahren heißt Destraktion, ein Kunstwort aus Destillation und Extraktion.
Das muss erklärt werden:
Für jedes Gas gibt es eine Kombination von Druck und Temperatur, oberhalb derer es nicht verflüssigt werden
kann. Das ist der kritische Punkt. Dieser liegt für CO2 bei 76,3 bar und 31 °C.
Überkritisches CO2 ist also gasförmig. Man kann es aber dennoch so komprimieren, dass es wie
eine Flüssigkeit aussieht und sich auch so benimmt. Das ist aber keine Verflüssigung im Sinne der Änderung
der Aggregatszustände! Eine praktisch angewandte Temperatur-Druckkombination ist z. B. 150 bar bei 80 °C.
Bereits das im Sinne des Wortes wirklich verflüssigte CO2 kann in Hochdruckextraktionen als Lösungsmittel dienen. Aber es erfährt beim Übergang in den überkritischen Zustand zusätzlich ein sprunghaft (d. h. um mehrere Zehnerpotenzen) ansteigendes Lösungsvermögen für viele unpolare Stoffe. Damit werden einzelne Substanzen aus komplexen Stoffgemischen selektiv herauslösbar. Das macht man besonders gern bei empfindlichen Naturstoffgemischen.
Man isoliert den gelösten Stoff, indem man das als Lösungsmittel wirkende überkritische CO2 abdestilliert und wieder in den Kreislauf schickt.
Auf diese Weise gelingt die schonende Reduzierung des Coffeingehalts von grünen Kaffeebohnen von 0,3 auf
etwa 0,1 %.
Der Vorteil ist: Die Abtrennung erfolgt ohne Lösemittel-Rückstände und unter Erhalt des geschätzten
Kaffeearomas.
Reagieren Alkaloide alkalisch?
Coffein gehört zur Gruppe der Alkaloide. Ist es deshalb etwa eine Base
oder reagieren seine Lösungen sogar alkalisch?
|
Versuch 5: pH-Wert einer Lösung von Coffein
|
Coffein reagiert also nicht alkalisch. (Die schwach saure Reaktion der Lösung rührt von im Wasser gelöstem CO2 her.)
Obwohl Xanthinderivate nicht alkalisch reagieren, zählt man sie wie schon gesagt zu den Alkaloiden. Darunter versteht man niedermolekulare, physiologisch wirksame Pflanzeninhaltsstoffe.
So sind auch die drei Xanthinderivate allesamt den Menschen stimulierende Substanzen pflanzlicher Herkunft mit starker physiologischer Wirkung. Jeder weiß, dass bei zu starkem Kaffee- und Teegenuss das Herz zu flattern beginnt. Denn Coffein regt beim Menschen das sympathische Nervensystem an und wirkt daher als Wachmacher. Fast wichtiger für die Medizin ist das Theophyllin: Es wirkt gegen Bronchialasthma und gehört zu den wichtigsten Herzmitteln, da es die Herzleistung steigert und die Durchblutung der Coronargefäße fördert. Hinzu kommt seine harntreibende Wirkung. Es gibt also eine Menge Gründe, warum Coffein Bestandteil vieler Medikamente ist.
|
Versuch 6: Nachweis von Stickstoff in Coffein
|

Bild 5 (Foto: Daggi)
Beim Erhitzen wird also Ammoniak frei. Das ist ein Hinweis auf amid- oder
aminartig gebundenen Stickstoff. Betrachten wir die Strukturformeln, so finden
wir das Ergebnis bestätigt.
Obwohl Coffein nicht alkalisch reagiert, ist es dennoch eine schwache Base im Sinne von Brönsted. Man kann sogar Coffein-Salze herstellen. In diesen liegt Coffein protoniert, also als Kation vor.
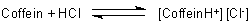
Deshalb kann Coffein Kationenaustauscher-artig an Gerbsäuren gebunden werden. Damit können wir folgendes erklären:
Warum wirkt Tee schonend langsam anregend, Kaffee dagegen
schnell?
Das erstaunt, weil ja im Tee prozentual drei bis vier Mal mehr Coffein
enthalten ist als im Kaffee. Man muss wissen, dass Coffein in den Pflanzen an
Säuren gebunden ist, und zwar insbesondere an gerbsäurenartige Verbindungen wie
die Flavanole oder die Chlorogensäure.
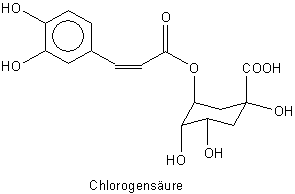
Dabei handelt es sich um empfindliche Polyphenole. Sie binden die schwache Base Coffein:
R-OH + C ———> [R-O-] [CH+]
Im Tee sind diese und andere Gerbsäuren auch nach der oxidativen Fermentierung durch Phenoloxidasen noch in hoher Konzentration vorhanden (denken Sie an die Bitterstoffe!). Die Gerbsäuren wirken wie Ionenaustauscher und geben im Darmtrakt das Coffein langsam ab. Darauf beruht die belebende, aber nicht aufputschende Wirkung des Tees. Beim grünen Tee werden diese Oxidasen durch Erhitzen im Wasserdampf inaktiviert, so dass die Phenoloxidation unterbleibt.
Beim Kaffee dagegen wird ein großer Anteil der Gerbsäuren durch das Brennen weitgehend zerstört. Damit wird das Coffein nach dem Trinken des Kaffees im Darm sofort frei, gelangt in die Blutbahn und putscht auf. Danach geht es mit dem Kreislauf wieder rasch abwärts - deshalb schlafen viele Leute nach einer Tasse Kaffee besonders gut ein.
(Zur physiologischen Wirkung des Coffeins haben wir eine besondere Webseite.)
Welche Rolle spielt Coffein überhaupt in den Pflanzen?
Hierüber gibt das Buch "Ökologische Biochemie" von J. B. Harborne [2]
Auskunft:
Das Alkaloid ist nicht nur in der Kaffeebohne, sondern in der ganzen Pflanze
verteilt zu finden. Die Konzentration an Coffein steigt im Laufe der
Blattentwicklung stark an - ein Hinweis darauf, dass das Gift die Beweidung
durch Fressfeinde verhindern soll. Wie giftig die Substanz ist, zeigen Versuche
mit Raupen und Käfern, die entweder sterben oder sterilisiert werden.
Die alternden Pflanzenblätter wiederum sind nahezu frei von Coffein. Grund ist, dass
das Coffein abgebaut und der dabei freigesetzte Stickstoff von der Pflanze
weiterverwertet wird - ein Beispiel für biologisches Recycling.
Coffein ist also ein echter biochemischer Kampfstoff. Pflanzen setzen ihn übrigens auch
gegen andere Pflanzen ein. Offenbar wirkt er auch gegen Mikroorganismen.
Rüdiger Blume
Literatur:
[1] Belitz-Grosch-Schieberle: Lehrbuch der Lebensmittelchemie, Springer, Berlin 2001.
[2] J. B. Harborne: Ökologische Biochemie. Spektrum Akademischer Verlag, Heidelberg 1995.
[3] Nachtrag: Zum Thema Coffein gab es in der National Geographic Deutschland im Januar 2005 von T. R. Reid und B. Sacha einen hervorragenden Artikel: "Koffein - Die beliebteste Psychodroge der Welt". Unbedingt lesenswert!
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 25. Januar 2011, Dagmar Wiechoczek