Prof. Blumes Tipp des Monats September 2013 (Tipp-Nr. 195)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wenn β-Carotin explodiert
In der Entsorgungsstation unserer chemischen Fakultät knallt es zur Mittagspause. Man findet zunächst nichts - bis man zur Decke des ca. 5 m hohen Technikums blickt: In einer Abdeckplatte steckt der Schraubverschluss einer Chemikalienflasche.

Bild 1: Entsorgungstechnikum mit Chemikalienflaschenverschluss in der Deckenverkleidung
(Fotos: Daggi)
Was ist da explodiert?
Um das festzustellen, gehen die Leute wie die Polizei vor: Die braucht bekanntlich nur die Einschlagsrichtung
eines Geschosses festzustellen, um zu wissen, wo der Schütze stand. Hier ist es besonders einfach: Direkt unter
dem Loch in der Decke steht am Boden eine Kiste mit zur Entsorgung abgegebenen Chemikalien-Gebinden. Einer unscheinbaren
Flasche fehlt der Schraubverschluss. Der steckt oben in der Decke. Es handelt sich um die Biochemikalie
β-Carotin!

Bild 2: Ursache für den Deckenschuss
(Fotos: Daggi)
Diese Flasche war im Praktikumslabor bei der Entrümpelung eines Kühlschranks angefallen. Auf der Entsorgungsstation
hat sich die Flasche auf Zimmertemperatur erwärmt. Dies hat offenbar ausgereicht, die Zersetzungsreaktion einzuleiten.
Glücklicherweise war die Flasche nach dem Prüfen nicht mehr richtig verschraubt worden - sonst wäre das Glas unter
Splitterbildung mit ganz anderen Folgen explodiert.
Was ist die Ursache?
Offenbar hat sich ein Peroxid gebildet
Wir erinnern uns: Organische Peroxide gehören zu den gefährlichsten Substanzen in Laboratorien.
Jedem sind wohl die Etherperoxide bekannt, vor denen jeder Anfänger im chemischen Labor gewarnt wird.
Aber β-Carotin?
Man staunt, wie viele organische Substanzen beim Stehen mit Luftsauerstoff Peroxide und Hydroperoxide bilden. Davon sind nicht nur die Ether betroffen. Auch ungesättigte Verbindungen wie Alkene (und da vor allem die Polyene) sind hochpotente Peroxidbildner. Und β-Carotin ist ein Vertreter der Polyene.
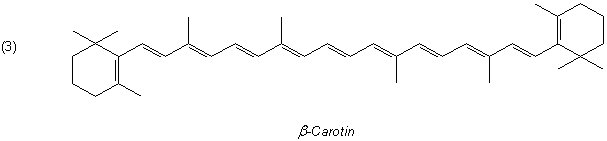
Hier sind einige potente Peroxidbildner
| - | Ether und Cycloether |
| - | Acetale mit α-ständigem Wasserstoff |
| - | Alkene |
| - | Diene und Polyene |
| - | Alkane und Cycloalkane mit tertiärem Wasserstoff |
| - | Sekundäre Alkohole |
| - | Aldehyde. Das betrifft auch Benzaldehyd als künstliches Bittermandelöl, das in Küchenschränken vor sich hingammelt. |
| - | Ketone mit α-ständigem Wasserstoff |
| - | Hinzu kommen natürlich alle Monomere, die zur radikalischen Synthese von Kunststoffen eingesetzt werden. |
| - | Als Peroxidbildner kommen auch einige als Entfettungsmittel eingesetzte ungesättigte Halogenkohlenwasserstoffe in Betracht (z. B. Tetrachlorethylen). |
Der Reaktionsmechanismus - kurz gefasst
Eingeleitet wird die Hydroperoxidbildung durch eine Radikalbildung, ausgelöst durch Licht, Radikale und andere Peroxide.
Betroffen sind vor allem Verbindungen mit α-ständigem („allylischem“) Wasserstoff.
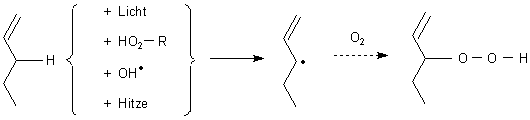
Dabei sei daran erinnert, dass auch Sauerstoff ein (Bi)Radikal ist.
Bei halogenierten Kohlenwasserstoffen wird zur Radikalbildung vor allem das Halogenatom abgespalten.
Diese Peroxide können sich explosionsartig zersetzen. Bemerkenswerterweise neigen sie auch dazu, in einem radikalischen Kettenmechanismus explosionsartig zu polymerisieren, denn diese Autopolymerisationsreaktionen sind stark exotherm. Wir kennen das von entsprechenden radikalischen Kunststoffsynthesen.
Das Einhalten der Laborschutzbestimmungen ist unerlässlich
Wer mit potentiellen Peroxidbildnern arbeitet oder sie gar destilliert, sollte unbedingt alle Personenschutzbestimmungen
einhalten. Hier zeigen wir die Brille eines Praktikanten, der Ether destilliert hat - nach der Explosion der Destillationsapparatur.

Bild 3: Brille mit Einschlag
(Foto: Daggi)
Man erkennt rechts deutlich den "Impact" eines Glassplitters, der nur durch das Verbundglas der Brille aufgehalten wurde.
Zur Stabilisierung setzt man Inhibitoren hinzu
Bei diesen handelt es sich um Radikalfänger. Gefährdete Substanzen werden von der Industrie entsprechend präpariert. Allerdings
verbrauchen sich diese Inhibitoren mit der Zeit, da sie abreagieren. Deshalb sollte man auch stabilisierte Substanzen nicht allzu
lange aufbewahren. Das gilt vor allem für häusliche Privat- und Schullabore, in deren Sammlungen sich immer noch wahre
Chemie-Fossilien befinden.
Viele unerklärliche Unfälle haben ihre Ursachen in der
Bildung von Peroxiden
Sagenhaft sind Küchenbrände. Da sind zunächst die Friteusenbrände zu nennen, die auf altes, verdorbenes und deshalb
peroxidhaltiges Frittenfett zurückzuführen sind.
Hinzu kommen Spontanentzündungen von Dunstabzugshauben: In denen sammeln sich ungesättigte Fette sowie ungesättigte Zersetzungsprodukte wie Acrolein. Dabei bleiben sie immer mit warmer Luft in Kontakt. Das reicht aus, um die Peroxidkonzentration mit der Zeit so stark zu erhöhen, dass es knallt. Vielleicht wirken dabei auch Schwermetalle als Katalysatoren mit. Wir lernen daraus: Dunstabzugshauben muss man des Öfteren reinigen.
Vielleicht ist aber auch der folgende Unfall anhand von Zersetzungsreaktionen von Peroxiden erklärbar:
| Der Hausmeister eines Dentallabors entsorgt Chemikalien im Müll. Dabei kommt es zu einer heftigen Explosion. Der Mann wird schwer verletzt. (Leopoldshöhe bei Bielefeld) |
Es kann sich aber auch um die unsteuerbaren Reaktionen zwischen starken Alkalien und Halogenkohlenwasserstoffen handeln.
Egal was die Ursache war: In diesem Betrieb scheint es Mängel bei der Entsorgung von Chemie-Abfällen zu geben. Die Richtlinien sind dringend zu überarbeiten.
Dieser Tipp des Monats wird vielleicht den einen oder anderen Chemielehrer (Chemielehrerin) veranlassen, noch einmal die Sammlung auf chemische Fossilien durchzusehen. Dazu gehören auch Alkali- und Erdalkalimetalle, die bei längerem Stehen explosive Metallperoxide bilden.
Der Appell zum Aufräumen betrifft weiter den einen oder anderen Privatmann, der in Keller, Werkstatt und Schuppen noch so einiges an alten Lösemitteln herumstehen hat. Wer weiß schon, was da noch an tickenden Zeitbomben schlummert!
Insgesamt lernen wir aus unserem Unfall im Entsorgungstechnikum, dass man ohne genaue Hinweise keine tiefgekühlt gelagerten Chemikalien zur Entsorgung geben darf.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 02. Februar 2015, Dagmar Wiechoczek