Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Januar 2016 (Tipp-Nr. 223)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Der erste Frost - wann stelle ich das Brunnenwasser ab?
Uwe Lüttgens
Mit dieser Frage muss sich jeder Gartenbesitzer beschäftigen, der einen Brunnen betreibt, um seine Pflanzen zu wässern oder bei sommerlichen Temperaturen
eine herrlich kalte Dusche in freier Natur zu genießen. Die Antwort ist einfach: Bevor der Winter einbricht, also rechtzeitig vor dem ersten Frost. Allerdings
kommt dieser manchmal überraschend! Klick mich an! Bild 1: Der erste Schnee – und das Gartenwasser ist noch nicht abgestellt
Bild 2: Nach dem Eindampfen des Brunnenwassers zeigen sich Ablagerungen am Reagenzglas
Eine Messung der Leitfähigkeit ergab: Das Brunnenwasser hat eine Leitfähigkeit von 876 µS/cm. Zum Vergleich wurden auch die elektrische Leitfähigkeit von Leitungswasser
und entionisiertem Wasser (aus dem Ionentauscher in der Chemiesammlung) bestimmt.
Bilder 3-5: Von links nach rechts: Entionisiertes Wasser, Leitungswasser und Brunnenwasser
Bild 6: Schmelzkurven für Brunnenwasser und eine konzentrierte Salzlösung (Trendlinien) Wir sehen: Die Temperatur ändert sich kaum, während die beiden Wasser-Proben auftauen. Ist ja auch klar: Die Wärmeenergie, die von außen zugeführt wird, sorgt dafür, dass ständig Eis schmilzt. Und das solange, bis nur noch flüssiges Wasser in den Proben enthalten ist.
Erst dann kann die Temperatur erneut ansteigen. Während dessen befinden sich sowohl Eis als auch bereits geschmolzenes Wasser in im Becherglas. Das Ergebnis verblüfft: Der Gefrierpunkt des Brunnenwassers liegt bei circa 0°C, also keinesfalls, wie angenommen, deutlich unterhalb des Gefrierpunkts von reinem Wasser und in der Nähe des Plateaus der tauenden konzentrierten Salzlösung. ΔTG = kG · b (Dimension: °C oder auch K) Die kryoskopische Konstante kG ist ein Wert, der für jedes Lösungsmittels charakteristisch ist. Für Wasser beträgt sie 1,86 K · kg · mol-1. Die Molalität b ist die Angabe der Stoffmenge n des gelösten Stoffes, bezogen
auf die Masse m des verwendeten Lösungsmittels,
in unserem Fall also Wasser. Sie wird in mol / kg angegeben.
ΔTG = kG · b · 2 = 1,86 K · kg · mol-1 · 2,7 · 10-3 · mol · kg-1 · 2 ≈ 0,01 K Damit ist die Gefrierpunkterniedrigung mit einem einfachen Thermometer nicht messbar.
Bilder 7-8: Pt-100-Thermometer mit Messgerät
Während das Brunnenwasser im Reagenzglas einfriert, messen wir über einen längen Zeitraum einen konstanten Widerstand von 99,852 Ω.
Mit Hilfe einer kompliziert aussehenden Formel kann aus dem gemessenen Widerstand die Temperatur berechnet werden [4]:
T = 3383,81 – 0,08658 · √ (1,75848 · 109 - 2,31 · 106 · R)
Damit ergibt sich TG zu -0,374 °C; gerundet sinkt die Temperatur also auf -0,4 °C ab.
(Foto: Lüttgens)
Können Wasserleitungen oder Gartenschläuche im Garten bereits in Nächten mit leichten Minusgraden einfrieren? Mein Garten liegt am Rande Berlins - und Berlin
ist bekannt für sein hartes Wasser . Das Wasser, das aus dem alten Brunnen gepumpt wird, sollte
also reich an Elektrolyten sein. Reicht deren Konzentration bereits aus, damit das Brunnenwasser nicht gleich beim ersten Frost in den Leitungen einfriert?
(Foto: Lüttgens)


(Fotos: Lüttgens)
Das Berliner Leitungswasser ist nach den Angaben der Berliner Wasserbetriebe (Angaben aus dem Jahr 2014) mit Werten von ca. 660 µS/cm (Spandau) bis ca. 980 µS/cm (Tiefwerder) durchaus vergleichbar mit meinem Brunnenwasser.
Wo liegt nun der Gefrierpunkt des Brunnenwassers?
Elektrolythaltiges Wasser erstarrt bei tieferen Temperaturen als 0° Celsius. Diesen Effekt der Gefrierpunktserniedrigung haben wir an anderer Stelle bereits kurz erläutert.
Der dazugehörige Versuch „Gefrierpunktserniedrigung von Salzlösungen“ beschreibt die Durchführung der Messung.
Alternativ kann natürlich auch die Schmelztemperatur bestimmt werden, da diese identisch mit dem Gefriertemperatur ist. Man führt die Aggregatzustandsänderung quasi nur aus der anderen Richtung durch – von fest nach flüssig.
Diesen einfachen Versuch kannst du auch zu Hause durchführen.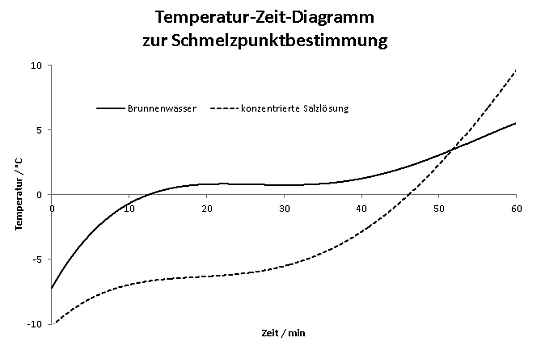
Einige physikalisch-chemische Überlegungen für Spezialisten
In Lehrbüchern [wie 1,2,3] lesen wir: Die Gefrierpunkterniedrigung einer Lösung ist nicht von der Art des gelösten Stoffes abhängig. Vielmehr sind allein dessen Konzentration und die Art des gewählten Lösungsmittels für
die Absenkung der Temperatur verantwortlich. Es spielt keine Rolle, ob und wie stark die Teilchen des gelösten Stoffes mit den Teilchen des Lösungsmittels miteinander wechselwirken.
Einschränkend muss gesagt werden: Dies gilt nur, solange die Lösung ausreichend verdünnt ist. Solche Lösungen, bei denen die Wechselwirkung zwischen den gelösten Teichen und den Teilchen des Lösungsmittels ähnlich stark ist,
wie die der Lösungsmittelteilchen untereinander, bezeichnet man als ideal. Bei höheren Konzentrationen wird es komplizierter. Daher beschränken wir uns mit unseren Überlegungen auf solche idealen Lösungen.
Wie kann nun der Effekt der Gefrierpunkterniedrigung erklärt werden? Dazu schauen wir uns erst mal an, was genau beim Erstarren von Wasser zu Eis passiert: Die Wassermoleküle beginnen sich in einem Gitter regelmäßig anzuordnen,
wenn sich ein Eiskristall bildet. Dies passiert bei reinem Wasser deutlich schneller als bei einer Salzlösung. Interessant und wichtig ist: Die Teilchen des in der Flüssigkeit gelösten Stoffes werden nicht in das Kristallgitter
eingebaut - das gefrorene Wasser ist rein.
Als Flüssigkeit bleibt eine Salzlauge zurück, die zunehmend höher konzentriert ist, je mehr Eis sich bildet.
Übrigens: Bei der Herstellung von Eiswein machen sich die Winzer diesen Effekt zu Nutze. Die Trauben werden erst bei deutlichen Minusgraden geerntet. Der Wein schmeckt sehr intensiv und süß, weil beim Ausfrieren des reinen Wassers
die Konzentration des Zuckers im zurückbleibenden Most deutlich ansteigt.
Zurück zu unseren Überlegungen: Die kleinsten Teilchen bewegen sich ständig, solange die Temperatur über dem absoluten Nullpunkt von -273,15 °C liegt. In Flüssigkeiten gleiten sie mehr oder weniger unregelmäßig aneinander vorbei. Bei
Feststoffen schwingen die Teilchen mehr oder weniger stark auf ihren Gitterplätzen hin und her. Kühlt man nun eine Flüssigkeit oder einen Feststoff ab, dann nimmt auch die Bewegung der Teilchen ab. Sie ordnen sich zunehmend regelmäßiger.
Mit sinkender Temperatur nimmt also die Entropie ab – sie gilt als Maß für die Unordnung in einem System. Dieser Effekt ist bei Flüssigkeiten deutlich ausgeprägter als bei Feststoffen, bei denen die Teilchen ja schon feste Plätze
im Gitter haben. Daher sinkt die Entropie beim Erstarren nach dem Übergang von der Flüssigkeit zum Feststoff nicht mehr so deutlich ab.
Nun zum elektrolythaltigen Wasser: Wird ein Salz in Wasser gelöst, steigt durch dessen Zugabe die Zahl der Teilchen im Wasser an. Folglich nimmt auch die Unordnung in der Lösung gegenüber der des reinen Lösungsmittels deutlich zu.
Entsprechend liegt die Entropie der Lösung bei jeder Temperatur über der des reinen Lösungsmittels. Da nur das reine Lösungsmittel erstarrt, ändert sich dessen temperaturabhängige Entropie nicht.
Am Gefrierpunkt stellt sich ein dynamisches Gleichgewicht an der Grenzfläche zwischen der Flüssigkeit und dem Feststoff ein. Teilchen verlassen den Kristall in Richtung Flüssigkeit, andere werden gleichzeitig in das Gitter eingebaut.
Die im Vergleich zum reinen Lösungsmittel höhere Unordnung in der noch nicht gefrorenen Lösung verhindert nun, dass das Wasser bereits erstarrt, wenn sein Gefrierpunkt erreicht ist. Zwar können nach wie vor die Wassermoleküle an der
Oberfläche des Eiskristalls diesen ungestört verlassen, der umgekehrte Weg ist jedoch erschwert. Die Ursache: An der Grenzfläche haben weniger Wassermoleküle in der Flüssigkeit Kontakt zum Eis, da dieser teilweise durch Teilchen des gelösten
Stoffes blockiert sind. Die Temperatur muss erst so weit absinken, bis sich das Gleichgewicht zwischen beiden Phasen erneut einstellt und pro Zeiteinheit gleich viele Moleküle in das Eisgitter eingebaut werden wie umgekehrt.
Wie stark die Gefrierpunkterniedrigung ausfällt, lässt sich berechnen
Eine einfache Formel ermöglicht die Berechnung:
Dazu drei wichtige Hinweise:
1) Bei Salzlösungen fällt die Temperatur stärker im Vergleich zu gelösten Stoffen, die nicht im Lösungsmittel dissoziieren, weil sich die Teilchenzahl durch den Zerfall des Kristallgitters in Kat- und Anionen entsprechend erhöht. Für eine
Kochsalzlösung heißt das: Die Molalität b muss mit dem Faktor 2 multipliziert werden, da beispielsweise 1 mol Natriumchlorid-Salz in der Lösung zu 1 mol Natrium-Ionen und 1 mol Chlorid-Ionen zerfällt. Eine kleine Verständnisfrage zwischendurch: Wie groß ist der Faktor für
ein Salz wie beispielsweise Calciumhydrogencarbonat oder Natriumphosphat?
2) Die Gleichung gilt nur für verdünnte ideale Lösungen. Bei konzentrierten Lösungen spielt die Wechselwirkung zwischen dem Lösungsmittel und dem gelösten Stoff zunehmend eine Rolle.
3) Bei Lösungen, in denen verschiedene Stoffe gelöst sind, erstarren innerhalb eines Temperaturbereiches. Ebenso ist zu berücksichtigen, dass durch die zunehmende Salzkonzentration in der zurückbleibenden Lösung der Gefrierpunkt weiter absinkt.
Anhand ähnlicher Überlegungen kann ebenso den Effekt der Siedepunkterhöhung erklärt werden.
Eine kleine Abschätzung
Aus den Analysedaten für das Berliner Wasser kann die Salzkonzentration des Leitungswassers abgeschätzt werden. Sie liegt realistisch um 300 mg Salz je Liter Wasser. Das Brunnenwasser wird eine ähnliche Salzkonzentration haben, wenn wir uns
nochmals die Messung der Leitfähigkeiten (Bilder 3-5) anschauen.
Nehmen wir als Beispiel das Wasser von Spandau. Bei einer Härte von ca. 15 °dH (Spandau) würde die Konzentration an Calciumcarbonat CaCO3 im Spandauer Leitungswasser ca. 270 mg/l betragen. Dies entspricht – wie man leicht anhand der Molmasse
des Salzes errechnen kann - 2,7 mmol/l.
Eingesetzt in die Gleichung für die Gefrierpunkterniedrigung ergibt sich:
Genauer kann die Temperatur mit speziellen Thermometern gemessen werden, bei denen der Effekt ausgenutzt wird, dass der elektrische Widerstand von Metallen mit steigender Temperatur zunimmt. Häufig wird ein Platindraht verwendet. Ein sogenanntes Pt-100-
Thermometer hat bei 0 °C einen Widerstand R von genau 100 Ω.

(Fotos: Lüttgens)
Mein Fazit
Ich merke mir: Wasserleitungen und Gartenschläuche frieren schneller ein als gedacht. Wenn der erste Frost kommt, sollte im Garten rasch gehandelt werden!
Literatur:
[1] P.W. Atkins: Physikalische Chemie. VCH Verlagsgesellschaft, 1. Auflage, Weinheim, Basel, Cambridge, New York 1988.
[2] P.W. Atkins, L. Jones: Chemical Principles, W.H.Freeman and Company, New York 2005.
[3] P.W. Atkins, J.A. Beran: Chemie – einfach alles, VCH Verlagsgesellschaft, 2., korr. Auflage, Weinheim, New York, Basel, Cambridge, Tokyo 1998
[4] R. Flesch: Messen in der Chemie, 3 Messung nicht-elektrischer Größen in der Physikalischen Chemie, Skript der Freien Universität Berlin 2015.
Diese Seite ist Teil eines großen Webseitenangebots
mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. Dezember 2016, Fritz Meiners
