Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Januar 2019 (Tipp-Nr. 259)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Die Innovation: Mizellenwasser
Sabine Streller
Mit diesem Begriff „die Innovation“ bewirbt einer der Hersteller das „besondere“ Wasser auf der Verpackung. Wenn Sie mit offenen Augen durch Drogeriemärkten oder Parfümerien gehen, so werden Sie feststellen, dass man inzwischen mit „Mizellenwasser“ verschiedenster Firmen zu unterschiedlichsten Preisen nahezu überschwemmt wird. Eines aber haben alle die Wässer gemeinsam: Schaut man sich die Liste der Inhaltsstoffe genauer an, dann finden sich da überhaupt kein Hinweis auf „Mizellen“… Grund genug, das Wasser mal genauer unter die Lupe zu nehmen. Machen wir uns auf die Suche nach den Mizellen. Bild 1: Ausschnitte von „Mizellenwasser“-Etiketten zweier Hersteller
Bild 2: Einphasiges „Mizellenwasser“ (links), zweiphasiges „Mizellenwasser“ vor (mittig) und unmittelbar nach dem Schütteln (rechts) – angefärbt mit Sudan III, um den Kontrast zwischen beiden Phasen zu erhöhen
Versuch 1: „Mizellenwasser“ im Mikroskop Einige Milliliter der zu untersuchenden Mizellenwasser werden mit einer Spatelspitze Sudan III angefärbt. Jeweils ein Tropfen der gut geschüttelten Mizellenwasserproben wird auf einen Objektträger gegeben und im Mikroskop bei einer Vergrößerung von 100x betrachtet. Ergebnis: Im „Mizellenwasser“ mit zwei Phasen sind kleine Tröpfchen zu erkennen, im einphasigen „Mizellenwasser“ ist nur eine klare Lösung erkennbar.

(Foto: Streller)
Was sind Mizellen?
Höchst beeindruckend beantwortet die Zeitschrift freundin diese Frage: „Mizellen sind winzige Moleküle aus der Nanotechnologie“ [1]. Ein Hersteller von „Mizellenwasser“ liefert eine andere Erklärung gleich auf der Flaschenrückseite: „Bei Mizellen handelt es sich um reinigende Wirkstoffe, die wie ein Magnet Unreinheiten und Make-up auf der Haut anziehen“ [2]. Ob es sich bei Mizellen nun wirklich um nanotechnologische Neuheiten oder Wirkstoffe handelt, werden wir gleich beleuchten. Doch vorher ein Wort zur Schreibweise: In der Kosmetik wird eher die Schreibweise Mizelle verwendet, in der Fachliteratur Micelle. Wir werden im Folgenden von Micellen schreiben, aber bei „Mizellenwasser“ bleiben, wenn wir das Produkt meinen.
Und was sind Micellen wirklich?
Seifen oder Tenside zeichnen sich dadurch aus, dass sie aus Molekülen bestehen, die einen hydrophoben (unpolaren) und einen hydrophilen (polaren) Teil besitzen.
Micellen sind einfach Zusammenlagerungen dieser Seifen- oder Tensidmoleküle, meist in Form einer Kugel, manchmal auch als kurze Röhre. Sehen wir uns mal am Beispiel von Seifen genauer an, wie sich Micellen bilden: Seifen sind langkettige Carboxylationen (also die Anionen von Fettsäuren) und besitzen - wie alle Tenside -einen hydrophoben und einen hydrophilen Molekülteil. Gibt man Seife in Wasser, so ordnen sich jeweils ungefähr 50 bis 100 der Carboxylationen in einer Art Ball an [2], indem die langkettigen, unpolaren Alkylreste (oft als „Schwanz“ bezeichnet) ins Innere des Balls ragen und die polaren Carboxylatgruppen (auch als „Kopf“ bezeichnet) nach außen weisen und sozusagen die Oberfläche der Kugel bilden. Die polaren Köpfe treten mit den sie umgebenden Wassermolekülen in Wechselwirkung, während die unpolaren Ketten im Inneren den Kontakt zum Wasser meiden. Micellen können allerdings erst entstehen, wenn eine Lösung ausreichend viele Seifenmoleküle enthält, so dass die Grenzschicht zur Luft als auch das Innere gesättigt ist. Die überschüssigen Moleküle aggregieren dann im Innern zu Micellen [3].
Micellen sind keine festen Partikel. Sie stehen in einem dynamischen Gleichgewicht mit den übrigen Ausgangsmolekülen in der Innenphase und der Grenzschicht [3]. Die Konzentration eines Tensids in Wasser bei der eine merkliche Micellenbildung auftritt, wird als kritische Micellbildungskonzentration (CMC) bezeichnet.
Eine Micelle ist also keine Hexerei, keine Innovation, kein Produkt der Nanotechnologie und auch kein Wirkstoff. Micellen entstehen einfach ganz von selbst und das hat energetische Gründe [2; 3]. Der Name Micelle leitet sich von mica (lat. kleiner Bissen) ab. Wie klein der Bissen ist, zeigt die Größe eine Micelle, sie ist nämlich nur zwischen 1 und einigen 100 Nanometer groß [3; 4]
Aber sind denn nun wirklich Micellen im „Mizellenwasser“?
Um dieser Frage nachzugehen, haben wir uns entschieden zwei „Mizellenwasser“ zu untersuchen: Eines, das zwei Phasen besitzt und eines, das nur aus einer Phase besteht. Das zweiphasige „Mizellenwasser“ hat eine untere farblose Phase und darüber eine gelbe Phase (Bild 1). Dieses „Mizellenwasser“ muss gut geschüttelt werden, bevor es verwendet werden kann. Beim Schütteln vermischen sich beide Phasen und für einige Minuten entsteht eine trübe, schaumige Lösung. Damit beide Phasen besser voneinander zu unterscheiden sind, haben wir das Mizellenwasser mit Sudan III (roter Farbstoff, der sich in Öl löst) angefärbt.
(Foto: Streller)
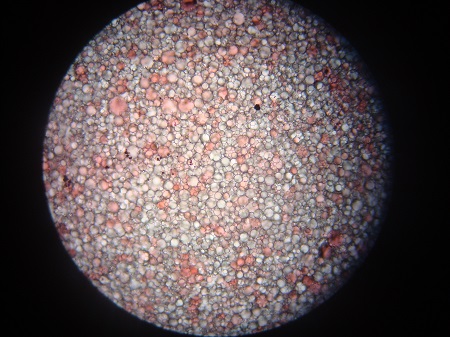
Bild 3: Zweiphasiges Mizellenwasser bei 100facher Vergrößerung; zum „Mizellenwasser“ angefärbt mit Sudan III
(Foto: Streller)
Doch sind diese kleinen Tröpfchen Micellen? Ein Blick auf die Größe einer Micelle – von wenigen Nanometern – und der Auflösung eines Lichtmikroskops zeigt, dass Micellen im Lichtmikroskop gar nicht zu erkennen wären. Was wir hier tatsächlich sehen, sind Öltröpfchen, die in der wässrigen Lösung emulgiert sind. Als Emulgatoren, die die Öl-in-Wasser-Emulsion stabilisieren, helfen die Tenside. Denn die Tensidmoleküle ordnen sich um Öltröpfchen ähnlich wie in einer Micelle an: Die polaren Köpfe ragen nach außen ins wässrige Medium und die unpolaren Schwänze ragen ins Öl. So entsteht eine relativ stabile Ölblase, die aber um ein Vielfaches größer ist als eine Micelle. Wir haben im Mikroskop zwar keine Micellen gesehen, können aber schlussfolgern, dass Tenside im „Mizellenwasser“ enthalten sein müssen, da die Emulsion über längere Zeit relativ stabil war. Nehmen wir uns also die Inhaltsstoffe auf der Verpackung nochmals vor: Das „Mizellenwasser“ mit zwei Phasen enthält 23 verschiedene Stoffe, das einphasige nur 7. Viele der Namen auf kosmetischen Produkten sind uns nicht geläufig und die Funktion der genannten Stoffe erschließt sich ebenfalls nicht auf den ersten Blick. Inhaltsstoffe von Kosmetika werden nach einer internationalen Vereinbarung – genannt INCI (englisch: International Nomenclature of Cosmetic Ingredients) – vorgenommen.
Ein Tipp: Eine hilfreiche Seite zur Funktion von Inhaltstoffe findet sich hier. Gibt man den Namen der Verbindungen ein, erfährt man so manches über diese Inhaltsstoffe, vor allem deren Funktion. In den von uns untersuchten „Mizellenwässern“ finden sich neben allerlei hautpflegenden, feuchthaltenden und konservierenden Stoffen auch verschiedene Tenside: z. B. Decyl Glucoside, Hexyleneglycol oder disodium cocoamphodiacetate.
Micellen sichtbar machen
Wenn Micellen also nur wenige 100 Nanometer groß sind, könnte der nach John Tyndall benannte Effekt helfen, sie aufzuspüren. Der englische Wissenschaftler entdeckte, dass Licht an kleinsten Schwebteilchen gestreut wird.
|
Versuch 2: Tyndall-Effekt von Mizellenwasser Geräte: Küvetten (ca. 5 cm Länge), Laserpointer, Wasser, „Mizellenwasser“
Die sauberen Küvetten werden mit Wasser bzw. dem zu untersuchenden „Mizellenwasser“ gefüllt. In einem abgedunkelten Raum wird nun mit einem Laserpointer durch die Küvette mit Wasser gestrahlt. Anschließend werden auf diese Art die zur Verfügung stehenden „Mizellenwässer“ untersucht. |

Bild 4: Lichtstrahl durch käufliches „Mizellenwasser“
(Foto: Streller)
Alle von uns untersuchten „Mizellenwässer“ zeigten den Tyndall-Effekt und streuten das Licht, genau wie eine Seifenlösung das auch tut.
„Mizellenwasser“ selbst gemacht
Na, Lust bekommen, selbst ein „Mizellenwasser“ herzustellen?
|
Versuch 3: „Mizellenwasser“ selbst herstellen Geräte: Wasser, Seife oder Spülmittel, ein Gefäß (oder Spülbecken) Mischen Sie etwas Wasser und Seife, z. B. indem Sie sich einfach die Hände waschen. Oder Sie spülen Geschirr. Sowohl das Wasser vom Händewaschen als auch Ihr Abwaschwasser ist Mizellenwasser! |
Schlusssatz: An dieser Stelle möchten wir der Kosmetikindustrie danke sagen, dass sie so schöne Themen für den Chemieunterricht aufwirft. Danke!
Quellen:
[1] https://www.freundin.de/beauty-was-ist-mizellenwasser (Zugriff 02.11.2018; 11:35)
[2] P. Bruice: Organische Chemie, Pearson Studium, München, 5. Aufl. 2007, S. 867.
[3] H. Mollet, A. Grubenmann: Formulierungstechnik. Emulsionen, Suspensionen, Feste Formen, Wiley VCH, Weinheim, 2000.
[4] V. Casteletto, I.W. Hamley: Small-Angle Scattering Functions of Micelles, Fibre Diffraction Review, 2003
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 20. Dezember 2018, Fritz Meiners