Prof. Blumes Bildungsserver für Chemie
Tipp des Monats März 2020 (Tipp-Nr. 273)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Gleichungen für komplexe Redoxreaktionen aufstellen – schrittweise zum Erfolg
Uwe Lüttgens
Zu den Herausforderungen im Chemie-Unterricht gehört es, für Redoxreaktionen Gleichungen aufstellen zu können. Regelmäßig erleben wir das Scheitern an dieser Aufgabe. Wir sollten, gerade wenn die Gleichungen komplexer werden, auf jeden Fall systematisch vorgehen. Und wir sollten dabei das Stoff-Teilchen-Konzept und das Donator-Akzeptor-Konzept im Hinterkopf haben und konsequent berücksichtigen. Der Erfolg stellt sich mit ziemlicher Sicherheit ein, wenn wir schrittweise nach einem „Kochrezept“ vorgehen und ausschließlich Ionengleichungen aufstellen. Hinweis: Im Tipp des Monats November 2010 (Tipp-Nr. 161) haben wir das Aufstellen von Redoxgleichungen am Beispiel der pH-Wert-abhängigen Reaktion von Permanganat-Ionen mit Eisen(II)-Ionen schrittweise erläutert. In einem weiteren Tipp (Tipp-Nr. 166) haben wir das Redox-Reaktionsverhalten einiger Sauerstoffsäuren des Schwefels behandelt.
Schrittweises Vorgehen lohnt sich
Handelt es sich um einfachere Reaktionsgleichungen, hat sich folgende Schrittfolge bewährt:
Aber seien wir ehrlich, es lauern doch zahlreiche Fallstricke, die die Angelegenheit erschweren. Sind das Stoff-Teilchen-Konzept und das Donator-Akzeptor-Konzept verstanden worden, dann gelingen die ersten beiden Schritte deutlich besser.
zu 1.
Erkennen wir die Ausgangsstoffe und die Reaktionsprodukte immer auf Anhieb? Oft scheitert es bereits daran, dass auf der Stoffebene verzweifelt nach möglichen Produkten Ausschau gehalten wird. Vielversprechender wäre es, nach den relevanten Teilchen Ausschau zu halten, die für die Reaktion eine Rolle spielen. Denn: Diese Teilchen zu identifizieren, ist zwingend notwendig, will man den zweiten Schritt erfolgreich durchführen. Hilfreich hierbei ist es, zuvor die Oxidationszahlen zu bestimmen.
zu 2.
Nun müssen für die korrespondierenden Redoxpaare Teilgleichungen aufgestellt werden. Zuzuordnen sind die Paare, weil sich während der Oxidation die Oxidationszahl erhöht und während der Reduktion erniedrigt.
zu 3.
Die vollständige Redoxgleichung aufzustellen, ist ebenfalls nicht ganz einfach, müssen doch sowohl die Anzahl der Teilchen als auch die Anzahl der Ladungen auf der Seite der Edukte und der Seite der Produkte ausgeglichen werden. Zur Erinnerung: Es reicht, eine Ionengleichung aufzustellen und nicht abschließend zu versuchen, die vollständige Reaktionsgleichung aufzustellen.
Eine detailliertere Schrittfolge
Die folgende ausführlichere Schrittweise [vgl. 1] soll dir helfen, Schritt für Schritt eine komplexe Redox-Reaktionsgleichung korrekt aufstellen zu können. Ungewöhnlich ist dabei, dass im Schritt 2.b)
- Sauerstoffatome O, die auf einer der beiden Seiten der Gleichung fehlen, durch Wassermoleküle H20 ausgeglichen werden.
- Da nun auf der anderen Seite Wasserstoffatome H fehlen, werden dort, wenn die Reaktion im sauren Milieu abläuft, Wasserstoffionen H- ergänzt.
- Wenn die Reaktion im basischen Milieu abläuft, werden auf der Seite, auf der H-Atome fehlen, erneut Wassermoleküle H20 ergänzt und auf der anderen Seite OH--Ionen hinzugefügt. Faktisch wird für jedes H20 – OH--Pärchen auf der Seite des Wassermoleküls genau ein Wasserstoffatom ergänzt.
- Identifizieren der Teilchen, die oxidiert bzw. reduziert werden. Dazu werden die Oxidationszahlen bestimmt.
- Aufstellen der Teilgleichungen für die Oxidation und die Reduktion
- Ermitteln der korrespondierenden Redoxpaare und der beteiligten Elektronen für die Oxidation und die Reduktion.
- Ausgleichen der Elemente in beiden Teilgleichungen. Sauerstoff- und Wasserstoffatome werden erst ausgeglichen, nachdem dies für die anderen Elemente durchgeführt wurde.
Saure Lösung: Die O-Atome werden durch Einsetzen von H20 ausgeglichen, die H-Atome durch Einsetzen von H-.
Basische Lösung: Die O-Atome werden durch Einsetzen von H20 ausgeglichen. Nun werden die H-Atome durch Einsetzen von H20 auf der Seite der Gleichung ausgeglichen, wo sie fehlen. Auf der anderen Seite werden entsprechend OH--Ionen ergänzt.
Neurale Lösung: Hier kann sowohl nach der „Kochanleitung“ für die saure wie für die basische Lösung vorgegangen werden.
- Aufstellen der Redoxgleichung
- Suchen geeigneter Faktoren, mit denen beide Teilgleichungen multipliziert werden, damit die gleiche Anzahl an Elektronen bei der Oxidation freigesetzt werden, die bei der Reduktion aufgenommen werden.
- Addition beider Teilgleichungen und Vereinfachen der Gesamtgleichung durch Wegstreichen von Teilchen, die auf beiden Seiten des Reaktionspfeils auftauchen.
Die pH-Abhängigkeit der Permanganat-Reduktion im Experiment
Wir wollen an einem bewährten Beispiel diese Schrittfolge ausprobieren: Die pH-Wert-abhängige Reaktion von Kaliumpermanganat mit Natriumsulfit. Dieses Beispiel findet sich häufig in den Lehrbüchern, die in der Oberstufe eingesetzt werden, wenn es im Chemieunterricht um die pH-Wert-Abhängigkeit von Redoxreaktionen geht. Hier ist die für Redoxreaktionen kennzeichnende Elektronenübertragung mit einem Protonenübergang gekoppelt, weshalb in solchen Fällen der Ablauf der Reaktion vom pH-Wert abhängt.
Warum Mangan?
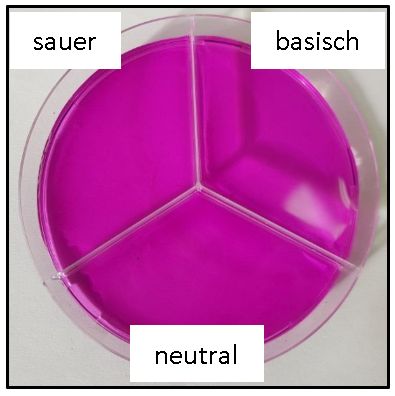
Auf der Teilchenebene kann die Reaktion deshalb gut interpretiert werden, weil sich die Teilchen, die oxidiert und die reduziert werden, aufgrund ihrer unterschiedlichen Farben in wässrigen Lösungen leicht identifizieren lassen: In saurer Lösung werden Permanganat-Ionen bis zu Mangan-Ionen reduziert. In neutraler oder schwach basischer Lösung entsteht Manganoxid (Braunstein), in stark basischer Lösung werden Manganat-Ionen gebildet. [2, 3]
| Edukt | pH-abhängige Produkte | ||
|---|---|---|---|
| basisch | neutral | sauer | |
| MnO4- | MnO42- | MnO2 | Mn2+ |
| Permanganat-Ion | Manganat-Ion | Mangandioxid (Braunstein) | Mangan-Ion | violett | grün | braun | rosa bis farblos |
Tabelle 1: Reaktionsprodukte der pH-abhängigen Reaktion von Permanganat-Ionen mit Sulfit-Ionen.
|
Versuch: pH-Abhängigkeit der Reduktion von Kaliumpermanganat durch Natriumsulfit Geräte und Chemikalien: Petrischale (dreigeteilt), Spatel, Pipette, Erlenmeyerkolben, Kaliumpermanganat-Lösung (c = 0,01 mol/L) (GHS05, GHS09), verdünnte Schwefelsäure (w = 10%) (GHS05), verdünnte Natronlauge (c = 1 mol/L) (GHS05), Natriumsulfit Durchführung: Alle drei Fächer der Petrischalen werden mit je 3 ml einer frisch hergestellten Kaliumpermanganat-Lösung befüllt. Anschließend werden durch Zugabe von jeweils 3 ml Flüssigkeit die drei Fächer mit Schwefelsäure angesäuert, mit Natronlauge alkalisch gemacht sowie mit Wasser verdünnt.
Bild 1: Kaliumpermanganat-Lösung bei unterschiedlichen pH-Werten
In alle drei Fächer geben wir anschließend eine Spatelspitze Natriumsulfit. Hinweis: Wir stellen eine 0,01 molare Kaliumpermanganat-Lösung her, indem wir 0,16 g KMnO4 in 100 ml Wasser lösen. Ergebnis: Bei der Reaktion von Kaliumpermanganat mit Natriumsulfit entstehen bei verschiedenen pH-Werten unterschiedliche Produkte, die sich an ihren unterschiedlichen Farben der Lösungen erkennen lassen.
Bild 2: Mit Natriumsulfit versetzte Kaliumpermanganat-Lösungen – mit dem Spatel verrührt
Bild 3: Nach einiger Zeit erkennt man in der neutralen Lösung (unten) an den braunen Flocken das ausgefallene Manganoxid (Braunstein). Im basischen Milieu (rechts) färbt sich die Lösung nach längerer Zeit ebenfalls bräunlich, weil das Manganat-Ion mit der Oxidationsstufe +6 nicht ausreichend stabil ist und Braunstein gebildet wird.
|
Die Ionengleichungen für die Permanganat-Reduktion
Die Aufgabe für die Lerngruppe könnte nach der Durchführung des Versuchs so lauten:
Stellen Sie die Reaktionsgleichung für die Reaktion einer schwefelsauren Kaliumpermanganat-Lösung durch Natriumsulfit auf.
Saures Milieu
Fangen wir also mit der Reaktion im sauren Milieu an: Die violette Lösung wird entfärbt – es sind Mangan MnO2+-Ionen entstanden. Gleichzeitig sind die Sulfit-Ionen sind zu Sulfat-Ionen oxidiert worden:
- Identifizieren der Teilchen

- Aufstellen der Teilgleichungen

- Aufstellen der Redoxgleichung
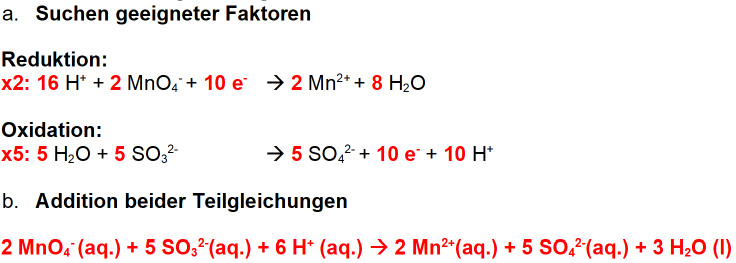
Basisches Milieu
Im basischen Milieu färbt sich die Lösung durch die gebildeten Manganat-Ionen MnO42- grün. Stellen Sie die Reaktionsgleichung für die Reaktion einer alkalischen Kaliumpermanganat-Lösung durch Natriumsulfit auf. Wenn die Aufgabe so lautet, dann muss anders vorgegangen werden:
- Identifizieren der Teilchen

- Aufstellen der Teilgleichungen

- Aufstellen der Redoxgleichung
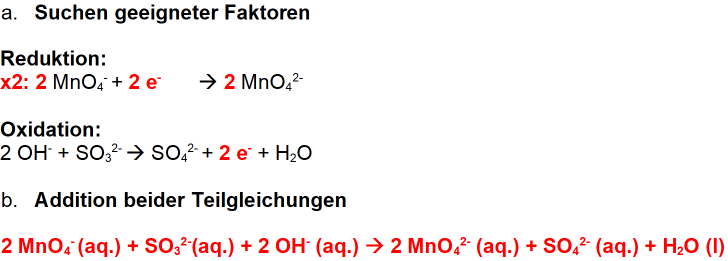
Neutrales Milieu
Ist die Lösung neutral, bildet sich Mangandioxid, also Braunstein. Die Aufgabe lautet also: Stellen Sie die Reaktionsgleichung für die Reaktion einer Kaliumpermanganat-Lösung durch Natriumsulfit auf. Nun können wir so vorgehen wie wir es bei den basischen Lösungen oder bei den sauren Lösungen besprochen haben. Fangen wir mit der „basischen“ Variante an:
- Identifizieren der Teilchen

- Aufstellen der Teilgleichungen

- Aufstellen der Redoxgleichung
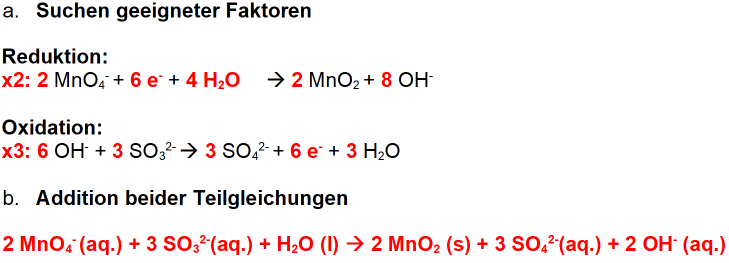
Nun die “saure“ Variante, die sich etwas einfacher gestaltet:
- Identifizieren der Teilchen

- Aufstellen der Teilgleichungen

- Aufstellen der Redoxgleichung
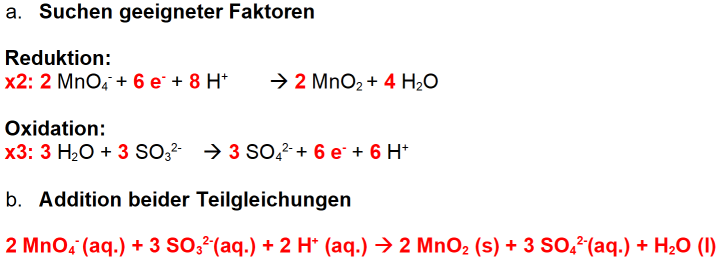
Ein letzter Hinweis für den Experimentator
Kommt die Lösung beim Experimentieren mit Kaliumpermanganat unbeabsichtigt auf die Finger, färben sich diese braun.
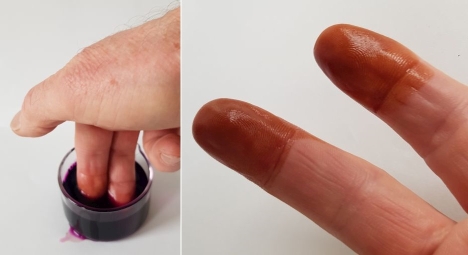
Bild 4: Einmal nicht aufgepasst, schon sind die die Finger braun
(Foto: Lüttgens)
Wir können es uns schon denken, warum: Das Permanganat-Ion wird durch organische Substanzen in der Haut reduziert. Um die Haut wieder zu „entfärben“, reichen bereits einige Tropfen schweflige Säure.
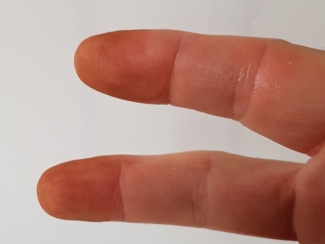
Bild 5: Saubere Finger dank Chemie!
(Foto: Lüttgens)
In die Säure eingetaucht bilden sich nun, wie wir wissen, Mangan MnO2+-Ionen. [2]. Die Reaktionsgleichung lautet:
MnO2 + SO2 –> MnSO4
Literatur:
[1] P. Atkins, L. Jones; Chemical prinziples, The quest for insight; W.H.Freeman and Company; New York 2005, S. 445 f.
[2] A.F.Holleman, E.Wiberg, N.Wiberg; Walter de Gruyter; Berlin 2007, S. 1618
Chemische Experimente im kleinen Maßstab, Akademiebericht 426, 3. durchgesehene Auflage 2009, Akademie für Lehrerfortbildung und Personalführung; Alp Dillingen 2009, S. 55
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 23. Februar 2020, Fritz Meiners