Prof. Blumes Tipp des Monats April 2011 (Tipp-Nr. 166)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Redox-Reaktionen einiger Sauerstoffsäuren des Schwefels
Sauerstoffsäuren des Schwefels sind nicht nur Protonenspender, sondern unter bestimmten Bedingungen auch aktiv an Redox-Reaktionen beteiligt. Das gilt auch für ihre Salze. Auf den Redox-Verhalten basieren viele Nachweisreaktionen, die auch in der Schulchemie bekannt sind. Hier stellen wir einige wichtige, im experimentell orientierten naturwissenschaftlichen Schulunterricht realisierbare Beispiele vor. Sie geben neben dem Einüben chemischer Experimentierkunst zusätzlich auch die Möglichkeit, das schrittweise Aufstellen von Redox-Reaktionsgleichungen zu üben und zu vertiefen.
Zuvor ein Hinweis zu den Reaktionsgleichungen: Im Folgenden bringen wir nur die der Schwefelsäuren bzw. ihrer Anionen. Die Redox-Gleichungen für die Reaktionsbeispiele sollten von den Schülern hergeleitet werden. Hier sind die Auflösungen.
1. Schweflige Säure und Sulfite
Beide sind auch in verdünnten Lösungen Reduktionsmittel. Die Oxidationszahl des Schwefels ist (+IV). Die Oxidation
führt zu S(+VI).
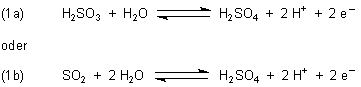
Da die meisten Reduktionsreaktionen schwach saures Milieu erfordern, geht man am besten gleich von Natriumhydrogensulfit NaHSO3 oder Natriumbisulfit Na2S2O5 (= „Na2SO3 · SO2“) aus.
|
Versuch 1: Reduktionsverhalten der Schwefligen Säure und Sulfite
|
2. Schwefelsäure
Schwefelsäure ist nur in konzentrierter Form redox-aktiv. Sie ist ein Oxidationsmittel. Das gilt nicht für ihre Salze, die Sulfate.
Im Allgemeinen muss man während der Reaktion erhitzen.
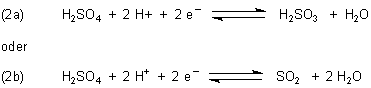
Wir sehen, dass dies die umgekehrten Reaktionen (1a) und (1b) sind.
Beispiele sind Reaktionen von edleren Metallen wie Kupfer oder Silber (nicht aber Gold und Platin). Bei unedlen Metallen wie Zink entsteht neben SO2 sogar auch elementarer Schwefel:
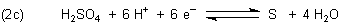
|
Versuch 2: Oxidationsverhalten der Schwefelsäure
|

Bild 1: Kupfer in konzentrierter Schwefelsäure.
Links vor dem Versuch, rechts danach. Beachten Sie den Papierstreifen mit Lugol-Lösung!
(Fotos: Daggi)
3. Thioschwefelsäure und Natriumthiosulfat
Die Thioschwefelsäure ist nicht stabil, deshalb interessieren wir uns nur für ihr Salz. Es handelt sich um Reduktionsmittel.
Mit starken Oxidationsmitteln wie Chlor bildet sich Sulfat.
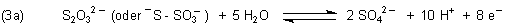
Diese Reaktion dient u. a. der Chlorentfernung aus Abwässern („Antichlor“).
Mit schwachen Reduktionsmitteln wie Iod dimerisiert das Thiosulfat-Ion nur; es entsteht Tetrathionat.
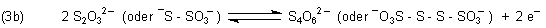
Diese Reaktion kennt man von der Iodometrie, der titrimetrischen Bestimmung von Oxidationsmitteln wie den Peroxiden. Dabei wird Iod aus Iodid gebildet. Das Iod wird anschließend mit genau eingestellter Thiosulfatlösung ins Farblose zurücktitriert.
|
Versuch 3: Reduktionsverhalten von Thiosulfat
|
Thiosulfat reduziert auch Wasserstoffperoxid. Darauf beruht eine wichtige Methode zur quantitativen
Bestimmung von H2O2.
4. Dithionsäure und Natriumdithionit
Die Dithionsäure ist nicht stabil, deshalb kümmern wir uns nur um ihr Salz. Es handelt sich um Reduktionsmittel.
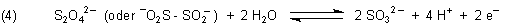
Natriumdithionit ist wichtig für die Küpenfärberei.
|
Versuch 4: Reduktionsverhalten von Dithionit
Der Versuch geht übrigens auch mit Methylenblau (bekannt vom “Blauen Wunder“ oder Blue-Bottle-Versuch) -> Dabei entstehen zwar zunächst Flocken, aber dann bildet sich langsam die farblose Lösung von Leukomethylenblau. (-> Reaktionsgleichung V04.) |

Bild 2: Küpen mit Natriumdithionit als Reduktionsmittel.
Links Indigo, rechts Methylenblau
(Foto: Daggi)
5. Peroxodischwefelsäure und Natriumperoxodisulfat
Zugänglich für Schullabors sind nur die Salze. Es handelt sich um starke Oxidationsmittel.
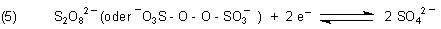
Aussagekräftige Reaktionsbeispiele findet man vor allem in der Mangan-Chemie. So wird Mn(II) zu Mn(IV), also Braunstein MgO(OH)2, oxidiert. In Gegenwart von katalytisch wirksamen Silber-Ionen wird sogar Mn(VII), also Permanganat, gebildet.
|
Versuch 5: Oxidationsverhalten von Peroxodisulfat
|
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 02. Januar 2015, Dagmar Wiechoczek