Prof. Blumes Tipp des Monats Januar 2015 (Tipp-Nr. 211)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Rauch ohne Feuer: Thiosulfat und Wasserstoffperoxid
Folgende Anfrage erreicht mich zum Thema „Schülerstreiche“:
|
Wir haben damals Rauchbomben gebaut. Verraten haben uns das wohl damals ältere Schüler. Anleitung:
|
Wir haben den Versuch nachgemacht. Er funktioniert. Es sei gleich darauf hingewiesen, dass die Dämpfe ätzend sind und nicht
eingeatmet werden dürfen. Deshalb ist der Versuch als Schülerscherz nicht geeignet - vor allem auch, weil die Platinen elektronischer
Geräte korrodieren könnten.
|
Versuch 1: Rauch ohne Feuer
|

Bild 1: Reaktion zwischen Thiosulfat und Wasserstoffperoxid
(Foto: Daggi)
Es bilden sich nebeneinander Natriumsulfat, Natriumhydrogensulfat und auch Schwefelsäure. Hier wird die Reaktionsgleichung der
zugrunde liegenden Redox-Reaktion hergeleitet.
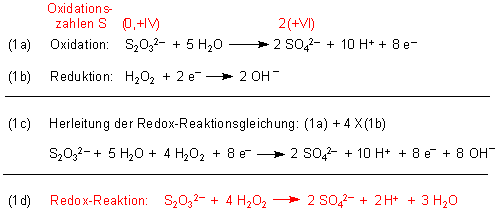
Aufgrund der freigesetzten Oxidationsenergie wird das System stark erhitzt, wobei Schwefelverbindungen wie H2SO4,
NaHSO4 und Na2SO4 sowie Wasser als Aerosole abdampfen und so den weißen Rauch bilden.
Einige Anmerkungen zum Versuch in der Anfrage:
1 Das Verkohlen des Papiers kann einerseits von der Hitze, andererseits von der entstandenen Schwefelsäure
herrühren. Letztere bildet auf aggressive Art und Weise Hydrate. Deshalb entreißt sie dem Kohlenhydrat
Cellulose das gebundene Wasser. Zurück bleibt Kohlenstoff. Das Papier zersetzt sich, wird braun und sieht verkohlt aus.
2 Zu den Wasserstoffperoxidtabletten: Die bestehen aus Carbamid-Peroxid, einem Wasserstoffperoxid/Harnsäure-Komplex. Diesen beschreiben wir im Tipp des Monats Nr. 101.
Mit Thiosulfat kann man indirekt die Konzentration von Wasserstoffperoxid ermitteln
Die direkte Reaktion zwischen Wasserstoffperoxid und Thiosulfat kann man wegen des unübersichtlichen Verlaufs nicht nutzen. Vielmehr
gibt es den schonenden Umweg über die Reaktion mit dem schwächeren Redoxsystem Iod/Iodid. Man nennt so etwas „gekoppelte Reaktionen“. Das
Verfahren heißt Iodometrische Bestimmung von Wasserstoffperoxid.
Zunächst lässt man Wasserstoffperoxid mit einer überschüssigen Iodid-Lösung reagieren:
(2a) H2O2 + 2 I ¯ ———> 2 OH ¯ + I2
(Um die Reaktion quantitativ nach rechts zu verschieben, muss die Lösung angesäuert werden.)
Das entstandene Iod wird mit einer genau eingestellten Lösung von Natriumthiosulfat titriert.
Indikator ist lösliche Stärke. Bei der Reduktion von Iod bildet sich Tetrathionit.
(2b) I2 + 2 S2O32 ¯ ———> 2 I ¯ + S4O62 ¯
Formal können wir die beiden Gleichungen addieren:
(2c) H2O2 + 2 S2O32 ¯ ———> 2 OH ¯ + S4O62 ¯
Dieser Gesamtgleichung entnehmen wir, dass ein Mol Thiosulfat ½ Mol Wasserstoffperoxid entspricht.
|
Versuch 2: Iodometrische Bestimmung von Wasserstoffperoxid
|
Auswertung:
Die Molmasse von H2O2 ist 34 g/mol bzw. 34 mg/mmol
1 ml Thiosulfatlösung (c = 1 mol/l) = ½ mmol H2O2 = 17 mg H2O2
Beim Titrieren mit 0,1-molarer Lösung (wie im Versuch 2) gilt
1 ml Thiosulfatlösung (c = 0,1 mol/l) = 1,7 mg H2O2
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 19. Dezember 2014, Dagmar Wiechoczek