Prof. Blumes Tipp des Monats November 2005 (Tipp-Nr. 101)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
 |
 |
| Bild 1 (Fotos: Blume) |
Carbamidperoxid - das feste H2O2
Weiße Zähne gehören heute zum gesunden Menschen wie die kalte Nase zum gesunden Hund. Früher reichte das mechanische Putzen. Dazu nahm man die gute, alte, wenn auch schlechtschmeckende und dazu schmirgelnd-kratzige Schlämmkreide. Die wurde aus mehr oder weniger fein gemahlener echter Kreide gemacht.
Heute sind allerlei Substanzen und Zusätze nötig, um unsere Zähne rundherum zu schützen und zu weißen. Man lese nur die Angaben zur Zusammensetzung von Zahnpflegemitteln, die auf den Verpackungen zu finden sind. Wenn man das alles schlucken würde! Trotzdem: Wir schlucken davon mehr als wir glauben.
Damit das Gebiss auch wirklich weiß wird, setzt man allerlei Bleichchemikalien ein, wie zum Beispiel Wasserstoffperoxid-Harnstoff (Harnstoffperoxid, Harnstoff-Peroxohydrat). Seine Formel ist
H2N-CO-NH2 · H2O2
Zur Erinnerung: Harnstoff ist das Diamid der Kohlensäure, daher die Bezeichnung Carbamid. Aus diesem Grunde ist eine andere Bezeichnung für Harnstoffperoxid Carbamidperoxid.
Es handelt sich weniger um eine echte chemische Verbindung als um ein Addukt. Das wird durch die folgende Strukturformel symbolisiert. Das Symbol "mix" steht für nicht genau definierbare Verhältnisse.
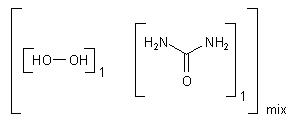
Seine Herstellung gelingt nur, weil Harnstoff unempfindlich gegen Oxidationsmittel wie Wasserstoffperoxid ist.
Wo bekommen wir Carbamidperoxid her?
Wir können zunächst versuchen, die Substanz selber zu synthetisieren. Das ist aber wenig erfreulich, wenn wir
nur schulische Mittel zur Verfügung haben. Ihr könnt es ja mal versuchen. Hier ist die Vorschrift.
Unser Ergebnis sah so aus:

Bild 2: Selbst hergestelltes Carbamidperoxid
(Foto: Daggi)
Glücklicherweise gibt es für Carbamidperoxid viele Einsatzmöglichkeiten - letztlich dort, wo man auch
Wasserstoffperoxid nutzt: Zum Desodorieren, zur Desinfektion und zum Bleichen. Deshalb können wir die Substanz
auch kaufen, zum Beispiel bei Merck. Man muss nur wissen, unter welchem Namen im Katalog zu
suchen ist. Am besten ist es, wenn man im Register für die Summenformeln nachschaut. Dazu muss man die
chemischen Symbole des Carbamidperoxids in alphabetischer Reihenfolge richtig anordnen:
CH6N2O3
So finden wir unser Carbamidperoxid im Katalog unter der Bezeichnung Perhydrit® in Tablettenform (Bestellnummer 107201; 100 g kosten etwa 24 €). Halb so teuer ist Wasserstoffperoxid-Harnstoff zur Synthese (Bestellnummer 818356; 100 g kosten etwa 12 €).
Sicherheitsbelehrung
Carbamidperoxid ist brandfördernd und ätzend. Seine Gefahrensymbole sind (O, C). Das Gefäß darf nicht erwärmt
oder gar erhitzt werden und sollte im Kühlschrank aufbewahrt werden. Feuergefahr bei Berührung mit brennbaren
Stoffen möglich.


Carbamidperoxid ist im sauren Milieu einigermaßen stabil. Deshalb wird es mit Spuren von Säure inaktiviert. Aus diesem Grunde reagieren seine Lösungen schwach sauer.
Vorm Experimentieren eine Vorbemerkung
Harnstoff und Carbamidperoxid kühlen sich beim Lösen stark ab. Das können wir in einem Vorversuch mit Harnstoff
zeigen:
|
Versuch 1: Harnstoff hat eine große Lösungswärme
|
Harnstoff hat also eine große Lösungswärme. Deshalb müssen wir vor den Experimenten unbedingt dafür sorgen, dass die Lösungen auf Zimmertemperatur gebracht werden!
Zunächst untersuchen wir das gekaufte Carbamidperoxid
Wir gehen davon aus, dass sich beim Lösen Harnstoff und Wasserstoffperoxid voneinander lösen und einzeln
nachweisbar sind. Wasserstoffperoxid weisen wir mit Titanylsulfat nach.
Für den Harnstoff gibt es einen enzymatischen Test, die Urease-Reaktion.
Glücklicherweise ist die unverwüstliche Urease auch in Gegenwart von Wasserstoffperoxid aktiv. Auch für
Wasserstoffperoxid gibt es einen Enzymtest. Dazu verwenden wir die im Blut reichlich enthaltene
Katalase oder gleich Citratblut.
|
Versuch 2: Analyse von Carbamidperoxid
a) Nachweis von H2O2
b) Nachweis von Harnstoff mit Urease
|

Bild 3: Ergebnisse von Versuch 1 (Foto: Daggi)
(Gläser 1 und 4 sind Blindproben)
Nun können wir auch die Zahnbleichmittel untersuchen.
|
Versuch 3: Untersuchung von Zahnpflegemitteln
|
Mittlerweile gibt es auch andere Bleichmittel. Gemeinsam ist allen jedoch der Gehalt an Peroxiden.
Peroxide bleichen Farbstoffe
Dazu müssen wir aber einiges beachten. Zum Bleichen ist neutrales bis alkalisches Milieu notwendig. Die Lösung
von Carbamidperoxid ist schwach sauer; wir haben den pH-Wert 4,8 gemessen. Im Mund stellt sich der neutrale pH-Wert
bald ein, da der Speichel gut puffert.
|
Versuch 4: Carbamidperoxid bleicht Farbstoffe
|
Das Bleichen geht viel besser als mit Wasserstoffperoxid (-> Versuch).
Auch der Friseur und die Friseurin nutzen Carbamidperoxid
Denn damit können sie die Haare ihrer Kunden bleichen.
|
Versuch 5: Haare bleichen mit Carbamidperoxid
|

Bild 4: Haare bleichen mit Carbamidperoxid (Foto: Daggi)
Für die Haarspende Dank an Sergej!
Deshalb ist es auch in Haarbleichmitteln enthalten. Dies können wir mit Versuch 2 nachweisen.
Carbamidperoxid - das feste H2O2
Mit Carbamidperoxid lassen sich alle gängigen Versuche durchführen, die auch mit Wasserstoffperoxid machbar sind.
Ersteres hat den Vorteil, dass es anders als die käuflichen Lösungen von Wasserstoffperoxid stabil ist. Hier sind zwei
Beispiele:
|
Versuch 6: Katalytische Zersetzung durch Braunstein
|
|
Versuch 7: Bildung von Chrom(V)-oxid
|

Bild 5: Einwirkung von Chromat auf Carbamidperoxid (Foto: Daggi)
(Links Chrom(V) und rechts Chrom(III))
Carbamidperoxid wirkt besser als Wasserstoffperoxid. Warum?
Wasserstoffperoxid wirkt gegenüber Reduktionsmitteln (wie Farbstoffen) als Oxidationsmittel.
H2O2 + 2 e- ———> 2 OH-
Deshalb bleicht es Farbstoffe.
Um zu verstehen, warum Carbamidperoxid besser wirkt, machen wir ein überraschendes Experiment.
|
Versuch 8: Glimmspanprobe mit Carbamidperoxid (Vorsicht! Schutzbrille!)
|
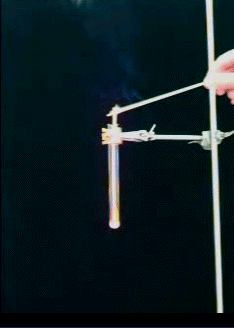
Bild 6 (Foto: Daggi) Hierzu gibt es einen Film (382 KB) Klicke hier |

Bild 7: (Foto: Daggi) Hierzu gibt es einen Film (143 KB) Klicke hier |
|
| (Filme: Daggi) | ||
Dieser Versuch macht eins deutlich: Das kann nicht nur Sauerstoff gewesen sein. Der würde den Glimmspan nur entzünden.
Wir werden an das Experiment mit dem chemischen Flammenwerfer (-> Webseite)
erinnert. Dort waren Radikale beteiligt. Tatsächlich bildet auch Carbamidperoxid beim Erhitzen gasförmige
Hydroxylradikale OH·. Es treten sogar Hydroperoxoradikale HO2· auf.
H2O2 ———> HO· + ·OH
H2O2 ———> HO2· + ·H
Solche hochreaktiven Radikale bilden sich auch in wässriger Lösung. Gefördert wird die Bildung durch unpolare Umgebung und höhere Temperaturen. Aus diesem Grunde ist Carbamidperoxid ein effektiveres Bleichmittel als Wasserstoffperoxid. Vor allem aber muss das Milieu, in dem es wirkt, nicht so alkalisch eingestellt werden wie beim Wasserstoffperoxid.
Last but not least
Ist es gesund, seine Zähne damit zu bleichen? Zähne enthalten Risse und Löcher, durch die die Substanz in den Zahn
eindringen kann. Ich würde das Zeugs nicht benutzen.
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 01. Oktober 2008, Dagmar Wiechoczek