Prof. Blumes Tipp des Monats Dezember 1998 (Tipp-Nr. 18)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Bild 1: Dagmar zeigt, wie man konzentrierte Schwefelsäure verdünnt |
Bild 2: Ergebnis des Zuckerkohle-Versuchs
|
Erst das Wasser, dann die Schwefelsäure...
Ein bekanntes Phänomen genauer untersucht
1 Das Problem
Der Merkspruch "Erst das Wasser, dann die Säure, sonst geschieht das Ungeheure" ist für viele von euch Schülern das einzige, was vom Chemieunterricht im Langzeitgedächtnis haften geblieben ist. Denn jeder sollte wissen, dass Schwefelsäure beim Verdünnen mit Wasser sehr heiß wird und dass ihr deshalb mit diesem Gemisch äußerst vorsichtig umgehen solltet. Im folgenden lernt ihr anhand eigener Versuche, was hinter dieser Gefahr steckt, die von einer der weltweit bedeutendsten Industriechemikalien ausgeht. So wurde bei einem Unfall in einer Chemiefirma durch Schwefelsäure ein Arbeiter verätzt. Der Mann wurde mit schwersten Verletzungen in ein Krankenhaus eingeliefert. Zu dem Unfall kam es, als eine Leitung beim Abfüllen eines Tanks riss.
Beachtet die Sicherheitshinweise für alle folgenden Versuche:
|
|
Versuch 1: Temperaturzunahme beim Mischen von Schwefelsäure
und Wasser
|
2 Warum konzentrierte Schwefelsäure beim Verdünnen so heiß wird
Der Grund hierfür ist, dass sie mit Wasser unter Wärmefreisetzung chemische Verbindungen eingeht. Anstelle von freien Oxonium-Ionen entstehen zunächst mit Wasser Schwefelsäureverbindungen ("Schwefelsäure-Hydrate") wie z. B.:
H2SO4 + H2O ———> H2SO4 · H2O /exotherm
(Lies: H2SO4 mit H2O.) Es bilden sich Hydrate mit bis zu 8 Wassermolekülen pro Molekül Schwefelsäure, also H2SO4 · 8 H2O. Diese Hydrate kann man sogar isolieren. Sie haben salzartige Strukturen wie z. B. [H3O+][HSO4-].
Ihre Bildungsreaktion ist stark exotherm. Die Energiemenge, die 1 Mol (entsprechend 98 g)
Schwefelsäure beim Verdünnen mit sehr viel Wasser freisetzt, beträgt 95,33 kJ (bei 20 ºC).
Zum Vergleich: Die molare Verdampfungswärme von Wasser beträgt 40,67 kJ/mol.
Die Reaktions-Energie der Schwefelsäure reicht also aus, um mehr als zwei Mol
Wasser (also 36 mL) zum Verdampfen zu bringen. Dies ist der Grund, weshalb
Wasser, das auf die Schwefelsäure gegossen wird, sich im Berührungsbereich der
beiden Flüssigkeiten stark erhitzt, augenblicklich verdampft und zusammen mit
Säure wie bei einem Siedeverzug aus dem Gefäß schießt. Außerdem
kann das Gefäß zerspringen.
Erst wenn die Hydratbildung abgeschlossen ist, kann die Schwefelsäure so weit
verdünnt werden, dass sie wie eine richtige Säure auch Protonen an weitere
Wassermoleküle unter Bildung freier Oxonium-Ionen abgibt. Nun reagiert sie auch mit unedlen
Metallen wie jede andere Säure unter Bildung von Wasserstoff und Salzen und leitet
den elektrischen Strom.
(Nun kann auch der Unterschied zwischen konzentrierter und verdünnter Schwefelsäure auf molekularer Ebene erklärt werden: In konzentrierter bis wenig verdünnter Schwefelsäure "kleben" die Ionen der Hydrate so stark zusammen, dass sie eine quasikristalline Einheit bilden. Beim weiteren Verdünnen schieben sich wie beim Lösen eines Natriumchlorid-Kristalls nach und nach so viele Wasserdipole dazwischen, dass die Hydrogenium-Ionen abgelöst werden und ihre "Säurewirkung" voll entfalten können. Deshalb leitet verdünnte Schwefelsäure (anders als die konzentrierte) den elektrischen Strom.)
3 Schwefelsäure ist hygroskopisch
Die Eigenschaft, Wasser an sich zu ziehen, nennt man Hygroskopie; der Stoff ist dann hygroskopisch (griech. hygrós feucht, skopéo schaue). Was das bedeutet, könnt ihr durch den Vergleich zweier Flüssigkeiten zeigen:
Lasst ihr Wasser offen stehen, so verdunstet es, und das Gefäß wird leichter. Anders ist es bei der konzentrierten Schwefelsäure: Diese nimmt an Masse zu. Wie kommt das?
Schwefelsäure zieht Wasser an und somit auch Wasserdampf aus der Luft. Deshalb findet sie auch als Trocknungsmittel z. B. im Exsikkator Verwendung. Es reicht aber nicht aus, die konzentrierte Schwefelsäure einfach an der Luft stehenzulassen, da in modernen Häusern aufgrund von Zentralheizungen und guter Lüftung die Luft zu trocken ist. Deshalb geht ihr am besten wie folgt vor:
|
Versuch 2: Nachweis der Hygroskopie von Schwefelsäure
(Den Versuch könnt ihr auch mit Glycerin oder mit Kaliumhydroxid anstelle von Schwefelsäure wiederholen.) |
4 Schwefelsäure zersetzt Biomasse
Die Tendenz von Schwefelsäure, Wasser an sich zu reißen, geht so weit, dass sie sogar aus organischen Molekülen Wasser abspaltet. Das kann man bekanntlich besonders gut an den Kohlenhydraten zeigen, die dabei verkohlen. Formal gilt:
C6H12O6 + 6 H2SO4 ———> 6 C + 6 H2SO4 · H2O /exotherm
Einen besonders schönen Reaktionseffekt erzielst du mit Saccharose (Rüben- oder Rohrzucker).
|
Versuch 3: Zersetzung von Saccharose durch Schwefelsäure (Zuckerkohle-Versuch)
|
Dass hierbei deutlich Schwefeldioxid zu riechen ist, zeigt, dass bei der Saccharosezersetzung auch komplizierte Redox-Vorgänge ablaufen. Lies dazu auch unsere Hintergrundinformationen.
 |
| Bild 3 (Foto: Blume) |
|
Versuch 4: Wirkung von Schwefelsäure auf Leinen
|
 |
| Bild 4 (Foto: Blume) |
Wegen dieser Fähigkeit, organisches Material zu zersetzen, ist die Schwefelsäure so aggressiv und gefährlich. Dafür gibt es sogar Beispiele aus der Geschichte.
5 Technische Anwendungen der Schwefelsäure-Hygroskopie
Die große Affinität zu Wasser ist aber auch Grundlage einiger technischer Verfahren: Taucht man z. B. Papier, das aus Cellulose besteht, kurzfristig in die Säure, so verkohlt es nicht, sondern wird in Pergamentpapier umgewandelt.
|
Versuch 5: Herstellung von Pergamentpapier
|
Wir lernen daraus, dass Pergamentpapier aus teilweise zerstörter Cellulose besteht. Deshalb gehört es auch nicht ins Altpapier.
Aber auch bei anderen chemischen Verfahren schätzt man die aggressive Hygroskopie der Schwefelsäure. Du kennst vielleicht die Veresterungsreaktionen, bei denen Schwefelsäure als Katalysator wirkt. Ein Beispiel:
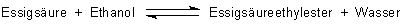
Genau genommen sind es ihre Protonen, die katalytisch wirken. Deshalb kann man hier auch jede beliebige Säure oder sogar saure Kationenaustauscher verwenden. Schwefelsäure absorbiert aber zugleich das Nebenprodukt Wasser und verschiebt damit das Gleichgewicht der Reaktion in Richtung auf Esterbildung.
6 Schwefelsäure-Hydrate kann man wieder zersetzen (oder: Wie man
Schwefelsäure recyceln kann)
Das hygroskopische Verhalten der Schwefelsäure hat für die Umwelt fatale Folgen:
Bei vielen chemischen Verfahren wie beim Aufschluss von Calciumphosphat zur Düngemittelgewinnung oder von Titanerzen sowie in der organischen Chemie benötigt man konzentrierte Schwefelsäure, die dabei auf einen Gehalt von etwa 20-30 % verdünnt wird.
Diese Abfall-Schwefelsäure zur Rückgewinnung zu entwässern, ist wegen der notwendigen Zerlegung der Schwefelsäure-Hydrate sehr energieaufwendig und teuer. Aus diesem Grunde schüttete man früher diese sogenannte Dünnsäure zu Tausenden von Tonnen einfach ins Meer ("Verklappen"). Die Folgen für die Umwelt waren teilweise verheerend. Die Säure wirkt zunächst ätzend auf die Meerestiere. Sie erwärmt das Meer an der Einleitungsstelle bis zum Kochen und versauert das Wasser. Hinzu kommt noch, dass die Dünnsäure große Mengen an giftigen Salzen und organischen Verbindungen enthält, die die Meeresorganismen vergiften.
Seit einigen Jahren hat man in Deutschland vom Verklappen der Dünnsäure Abstand genommen und ist zum Recyceln von Schwefelsäure übergegangen.
Zunächst kann man verdünnte Schwefelsäure destillieren. Deren Hydrate sind so stabil, dass sie bis 338 °C abdampfen. Zurück bleibt (allerdings je nach Herkunft mehr oder weniger stark verunreinigte) wasserhaltige Schwefelsäure mit einer Konzentration von 98,3 % (azeotropes Gemisch). Diese kann nicht mehr weiter durch Destillation angereichert werden.
Bei höheren Temperaturen beginnt jedoch die Zersetzung der Schwefelsäure:
H2SO4 ———> H2O + SO3 /endotherm
Bei 450 °C ist die Zersetzung der Schwefelsäure vollständig. Aus dem
Schwefeltrioxid kann reine Schwefelsäure zurückgewonnen werden.
Die hohen Energiekosten für die entsprechenden technischen Prozesse werden vor
allem durch ausgefeilte Verfahren zur Energierückgewinnung bei der
Schwefelsäuresynthese niedrig gehalten.
|
Versuch 6: Destillation und thermische Zersetzung von Schwefelsäure
(Unbedingt Abzug benutzen!) Gib 10 mL verdünnte Schwefelsäure (w = 50 % bzw. c = 5 mol/L wie bei der Ozondarstellung durch Schwefelsäureelektrolyse) (C) in eine Porzellanschale und erhitze kräftig. In die Dämpfe hältst du ab und zu ein feuchtes Universalindikator-Papier. |
 |
| Bild 5 (Foto: Blume) |
Rüdiger Blume
Literatur
- Schulbücher sowie zugehörige Lehrerbücher aus dem Cornelsen-Verlag wie z. B. Chemie für Gymnasien 2 (Brandenburg/Mecklenburg-Vorpommern/Sachsen-Anhalt), Berlin 1998; S. 31 ff.
- Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, Walter de Gruyter, Berlin-New York 1995.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek

