Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Mai 2020 (Tipp-Nr. 275)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Jens Schorn
Bild 1: Tischfeuer mit dem neuen und sicheren Brennstoff
Feuerstellen und Kamine ohne Schornstein sind attraktiv und werden in zahlreichen Varianten auch für den Indoor-Bereich seit Jahren angeboten. Obwohl diese Geräte schon seit langer Zeit getestet werden und vor den Risiken im Umgang mit ihnen gewarnt wird [1], versprechen viele Hersteller mit dem Motto „Einfach aufbauen und loslegen“ einen problemlosen und ungefährlichen Umgang mit den angebotenen Geräten. Leider geschehen immer wieder Unfälle mit schwersten Brandverletzungen mit Todesfolge [2]. Bei den käuflichen Produkten handelt es sich bislang meist um sogenannte Bioethanolkamine. Der verwendete Brennstoff ist also Ethanol, wobei der Hinweis Bio dafür steht, dass dieser Alkohol ausschließlich durch Vergärung aus Biomasse entstanden ist (klicke hier). Wird der Ethanol anders gewonnen, so spricht man von technischem Alkohol deren Herstellung man hier nachlesen kann (klicke hier). Egal aus welchen Prozessen Ethanol gewonnen wird, er ist leicht entzündlich und besitzt noch einige weitere gefährliche Eigenschaften, wie man den sogenannten Gefahrenhinweisen (H-Sätze [4]) entnehmen kann [3].

(Foto: Schorn)
H-Satz
Bedeutung
Piktogramm
225
Flüssigkeit und Dampf leicht entzündbar.

319
Verursacht schwere Augenreizung.

Für den Handel mit Ethanol ist deshalb das bekannte Symbol als Deklaration auf allen Verpackungen von Ethanol zu finden, wobei nach der sogenannten GHS Verordnung Lebensmittel, die für den Endverbraucher bestimmt sind, davon ausgenommen werden [5]. Sonst müssten hochprozentige Spirituosen ebenfalls dieses Symbol tragen.
Seit kurzer Zeit bietet die norwegische GmbH Steelwick AS mit dem oben gezeigten Tischfeuer in Bild 1 eine Alternative für Tischfeuer und Wohnzimmerkamine unter der englischen Bezeichnung Tender flame bzw. übersetzt „zarte Flammen“ an. In dem Werbevideo [6] wird gezeigt, dass der verwendete Brennstoff in keinem Fall leicht entzündlich ist. Hierbei wird der Brennstoff direkt in die brennende Flamme gegossen und großflächig verschüttet. In beiden Fällen entzündet sich der Brennstoff nicht. Würde man dies mit Ethanol machen, so drohe die Gefahr einer Stichflamme bzw. einer rückschlagenden Flamme in das Ausgangsgefäß mit anschließender Explosion. Um die Frage nach dieser erstaunlichen Eigenschaft zu beantworten, muss man wissen, welcher Stoff hier verwendet wird.
Welcher Stoff wird hier als Sicherheitsbrennstoff verwendet?
Die käuflichen 2,5 L Kanister enthalten eine farblose Flüssigkeit, die im Vergleich mit anderen Alkoholen so dickflüssig wie Glykol (Ethan-1,2-diol), aber flüssiger als Glycerin (Propan-1,2,3-triol) ist. Der Stoff ist geruchlos und lässt sich nur mit einer direkten Gasflamme (Feuerzeug) entzünden. Ein Streichholz reicht nicht aus.
Eine Recherche beim Hersteller zur Funktionsweise ergibt folgende Hinweise:
„Der Brennstoff besteht aus einer schwer entflammbaren und ungiftigen Flüssigkeit mit einem Flammpunkt von 104 °C (219 °F) …
… TenderFuel kann in unbegrenzten Mengen gelagert und ohne ADR-Zulassung transportiert/versendet werden. Bei der Lagerung verdampfen lediglich geringste Mengen; der Brennstoff ist vollkommen geruchlos.“ [8] (Bemerkung: ADR ist eine Vorgabe zum Transport von Gefahrstoffen).
Somit sind Flüssigbrennstoffe aus der Stoffgruppe der Kohlenwasserstoffe auszuschließen, da sie immer einen intensiven Geruch haben. Andere organische Flüssigkeiten, die so dickflüssig sind, sind zumindest hautreizend.
Ein Vergleich mit anderen dickflüssigen organischen Stoffen grenzt die Suche schnell auf die Stoffgruppe der mehrwertigen Alkohole ein [9].
Mehrwertige Alkohole im Vergleich:
| Stoff | Viskosität [mPas]1 | Geruch | Gesundheitsgefährdung [H-Sätze] | Siedepunkt [°C] |
|---|---|---|---|---|
| 1-Propanol | 2,3 | nach Ethanol | 225,318,336 | 97 |
| 2-Propanol | 2,2 | süßlich stechend | 225,319,336 | 82 |
| Ethan-1,2-diol | 20,81 | süßlich | 302,373 | 197 |
| Propan-1,3-diol | 44 | schwacher Eigengeruch | keine | 213 |
| Propan-1,2-diol | 45 | geruchlos | keine | 188 |
| Propan-1,2,3-triol | 1480 | geruchlos | keine | 290 |
| Sorbitlösung (70%ig) (1,2,3,4,5,6- Hexanhexaol) | 400 | karamellähnlich | keine | 295 |
Quelle: https://www.dguv.de/ifa/gestis/gestis-stoffdatenbank/index.jsp
1 Die Viskosität gibt an, wie Zähflüssig ein Stoff ist. Diese Größe wird mit der Einheit mPa*s angegeben. Es handelt sich hierbei um die Kraft die nötig ist, um zwei parallel angeordnete Platten, zwischen denen die betreffende Flüssigkeit fest an den Platten haftet, mit einer Geschwindigkeit von 1m/s gegeneinander zu verschieben.
Um aus den möglichen vier Stoffen ohne Gesundheitsgefährdung denjenigen herauszufinden, der in dem Tischfeuer verwendet wird, kann die Siedetemperatur bestimmt werden.
Die Bestimmung des vom Hersteller angegebenen Flammpunktes, also der Temperatur bei der sich über einem Stoff ein zündfähiges Dampf-Luft Gemisch bildet, ist nur mit Spezialapparaturen möglich.
|
Experiment 1: Bestimmung der Siedetemperatur des Sicherheitsbrennstoffs Geräte: Elektrische Heizplatte, Kleines Becherglas mit Silikonöl M1000, Reagenzglas mit seitlichem Ansatz an Stativ, Lochstopfen, Flüssigkeitsthermometer (Messbereich bis 300 °C), Winkelrohr mit Schlauchstück, Vorlage in Eisbad. Durchführung:
Bild 2 und 3: Apparatur zu Bestimmung der Siedetemperatur.
Beobachtung: Die Flüssigkeit siedet bei 184 °C. Ergebnis: Die Siedetemperatur von 184 °C entspricht der Siedetemperatur von Propan-1,2-diol. Diese Temperatur ist etwas niedriger als die Literaturangabe, da das Thermometer nicht tief genug im Reagenzglas steckte, sodass die Wärmeverteilung im Reagenzglas ungleichmäßig war. Der Luftdruck am Tage der Messung betrug 1012,2 mbar und entspricht dem Standarddruck. |
Wie funktioniert das Tischfeuer mit dem Sicherheitsbrennstoff?
Das Gerät zur Erzeugung eines Tischfeuers besteht aus dem Flüssigkeitsbehälter aus Glas, einem Dochtträger aus Metall und einem Spezialdocht. Der Dochtträger steht in dem Glasbehälter in dem Propan-1,2-diol.

Bild 4: Dochtträger (schwarz) und Spezialdocht (grau).
(Foto: Schorn)
Der Docht besteht aus einem feinmaschigen Drahtnetz, in dem das Propan-1,2-diol durch Kapillarität hochgezogen wird. Wird Propan-1,2-diol am oberen Ende durch eine Flamme verdampft, so entzündet sich der Dampf an der Luft und verbrennt.
Wieso ist dieser Stoff nicht so leicht entzündlich wie Ethanol?
Vergleicht man die Struktur von Ethanol mit der von Propan-1,2-diol, so besitzt Ethanol nur eine Hydroxygruppe.
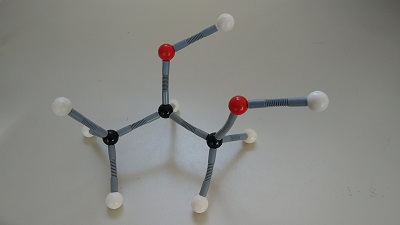
Bild 5: Kugelstabmodell von Propan-1,2-diol. Weiße Kugel-Wasserstoffatome, schwarze Kugel-Kohlenstoffatome, rote Kugel-Sauerstoffatome. Oben rechts die zwei Hydroxygruppen.
(Foto: Schorn)
Die Eigenschaften der mehrwertigen Alkohole hängen von der Anzahl und der Anordnung der Hydroxygruppen ab. Zwischen den einzelnen Alkoholmolekülen können über die Hydroxygruppen sogenannte zwischenmolekulare Wasserstoffbrücken entstehen. Diese Bindungen zwischen den Molekülen verändern die Fließeigenschaften (Viskosität) und die Energiemenge, die benötigt wird, um die Stoffe in einen anderen Aggregatzustand zu versetzen. Je mehr Hydroxygruppen, desto höher ist auch die Siedetemperatur. Da Ethanol nur eine Hydroxygruppe hat, verdampft der Stoff schon bei niedrigen Temperaturen (78 °C) und bildet leichter ein Dampf-Luft Gemisch, dass sich leichter entzünden lässt.
Welchen Nutzen hat dieser Sicherheitsbrennstoff für den Anfangsunterricht Chemie?
Um Feststoffe oder Flüssigkeiten für Verbrennungsvorgänge zu nutzen müssen diese Brennstoffe einen gasförmigen Aggregatzustand einnehmen, um brennbare Gasgemische zu bilden. Im Anfangsunterricht Chemie werden hierzu gerne Kerzenwachsexperimente, wie der sogenannte Glasröhrchenversuch gemacht (klicke hier).
Dabei wird Paraffinwachsdampf über ein Glasrohr aus dem Zentrum einer Kerzenflamme abgeführt. Dieser Dampf wird am oberen Rand entzündet und brennt auch ohne Docht weiter. Da Paraffinwachskerzen im Verdacht stehen gesundheitsschädliche Dämpfe zu bilden, ist der hier vorgestellte Brennstoff Propan-1,2-diol eine gute Alternative zu dem Glasröhrchenexperiment mit Kerzenwachs.

Bild 6: Glasröhrchenversuch mit Propan-1,2-diol. Ein Glasrohr 15 cm x 1,3 cm wird über den oberen Teil des Metalldochtes des Tischfeuers gehalten. Am oberen Rand brennt der entzündete Dampf des Brennstoffs mit bläulich-gelber Flamme.
(Foto: Schorn)
Der Hersteller der Tischfeuer und Wohnzimmerkamine verwendet mit Propan-1,2-diol hier also einen völlig unbedenklichen Brennstoff, der neben der sicheren Nutzung als Brennstoff auch keine weiteren Gesundheitsgefährdungen mit sich bringt. Dies beweist nicht zuletzt das entsprechende Sicherheitsdatenblatt [7]. Ein guter Beitrag zur Vermeidung von Unfällen und Gefährdungen.
Quellen:
[1] https://www.test.de/Ethanol-Kamin-Brandgefaehrliche-Deko-1832217-0/#id5551171 (zuletzt abgerufen am 19.04.2020)
[2] https://www.welt.de/regionales/nrw/article136922781/Die-unterschaetzte-Gefahr-der-Ethanolkamine.html (zuletzt abgerufen am 19.04.2020)
[3] https://de.wikipedia.org/wiki/Bioethanol (zuletzt abgerufen am 19.04.2020)
[4] https://de.wikipedia.org/wiki/H-_und_P-S%C3%A4tze (zuletzt abgerufen am 19.04.2020)
[5] https://ghs.portal.bgn.de/11972/56885/1 (zuletzt abgerufen am 19.04.2020)
[6] https://youtu.be/VIPhbi2P_dQ (zuletzt abgerufen am 19.04.2020)
[7] https://www.google.com/url?sa=t&source=web&rct=j&url=https://cdn.competec.ch/documents/8/3/836517/DE_Sicherheitsdatenblatt_Tenderfuel.pdf&ved=2ahUKEwirnf7WoJXnAhVPUlAKHd8_CJQQFjABegQIChAB&usg=AOvVaw2E0wGGHoicHRtwyyHKz8Ue (zuletzt abgerufen am 19.04.2020)
[8] https://www.tenderflame.de/tenderflame-funktionsweise/ (zuletzt abgerufen am 19.04.2020)
[9] https://www.chemieunterricht.de/dc2/r-oh/r-oh-05.htm (zuletzt abgerufen am 19.04.2020)
[10] https://www.chemieunterricht.de/dc2/grundsch/klasse1/kap_033.htm (zuletzt abgerufen am 19.04.2020)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 1. Mai 2020, Fritz Meiners
