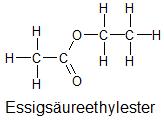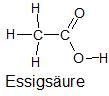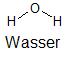Prof. Blumes Bildungsserver für Chemie
Tipp des Monats November 2021 (Tipp-Nr. 293)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Abgelenkte Flüssigkeiten – ein Hinweis auf die Polarität von Molekülen
Jens Schorn
Bild 1: Der Wasserstrahl krümmt sich deutlich, wenn ein elektrostatisch aufgeladener Ballon in der Nähe ist.
Mit einem Luftballon und einem feinen Wasserstrahl kann man das gezeigte Phänomen auch zuhause beobachten. Experiment 1: Ablenkung von Wasser durch einen Ballon Material: Luftballon, Wasserstrahl, Wollpullover oder Tierfell. Durchführung: Ein aufgeblasener Luftballon wird an einem Wollpullover oder einem Tierfell stark gerieben. Anschließend hält man den elektrostatisch aufgeladenen Ballon seitlich an einen feinen Wasserstrahl. Beobachtungen: Der Wasserstrahl wird zum Ballon hin in seiner Fallrichtung abgelenkt. Bild 2: Der Ballon wird dicht an den Flüssigkeitsstrahl gehalten.
Bild 3: Der Ballon wird weniger dicht an den Flüssigkeitsstrahl gehalten.
Ergebnis: Je näher der Ballon dem Wasserstrahl kommt, desto stärker erfolgt die Ablenkung des Wasserstrahls hin zum Ballon.

(Foto: Schorn)

(Foto: Schorn)
(Foto: Schorn)
Im Schulunterricht bleibt das Phänomen lange Zeit ungeklärt, bis man sich mit den allgemeinen Eigenschaften von Wasser, wie der Gefriertemperatur, der Siedetemperatur und den Lösemitteleigenschaften beschäftigt.
Warum erfolgt eine Ablenkung des Wasserstrahls?
Betrachtet man die Molekülstruktur von Wasser, so ist klar, dass sich dieser Stoff aus den beiden Elementen Wasserstoff und Sauerstoff zusammensetzt.
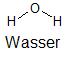
Strukturformel des Wassermoleküls
Diese beiden Atomsorten bestehen ihrerseits aus den Elementarteilchen Protonen, Neutronen und Elektronen, wobei für unsere Betrachtung nur die Protonen und Elektronen von Bedeutung sind. Verschiedene Arten von Atomen ziehen Elektronen einer chemischen Bindung unterschiedlich stark an. Diese Eigenschaft nennt man Elektronegativität. Sie beschreibt die Fähigkeit eines Atoms, das bindende Elektronenpaar, hier zwischen den Elementen Wasserstoff und Sauerstoff, stärker an sich heranzuziehen [1].
Wenn zwei Atome unterschiedlicher Elektronegativität in einem Molekül miteinander verbunden sind, dann werden die Elektronen, welche die chemische Bindung ausmachen, von den beiden Atomen unterschiedlich stark angezogen. Die Elektronegativitätswerte aller Elemente lassen sich nachschlagen: Sie finden sich in jeder Formelsammlung oder jedem besseren Periodensystem oder jeder besseren App. Ein Blick ins Periodensystem zeigt: Insgesamt befinden sich die Elemente mit hohen Elektronegativitätswerten (EN-Werte) oben rechts (mit Ausnahme der Edelgase in der 8. Hauptgruppe) und die Elemente mit niedrigen EN-Werten unten links.
EN (Wasserstoff) = 2,1
EN (Sauerstoff) = 3,5
Damit zieht der Sauerstoff die Bindungselektronen näher an sich heran und dies führt zu einem Ladungsüberschuss beim Sauerstoff. Diesen Ladungsüberschuss nennen wir Partialladung , da hier im Gegensatz zu einer Ionenbindung, die Elektronen auf den äußersten Atomschalen nicht vollständig ausgetauscht werden, sondern nur teilweise (partiell) verschoben sind. Diese Partialladung wird durch ein griechisches kleines Delta δ+ oder δ- dargestellt, das über oder unter das Elementsymbol geschrieben wird.
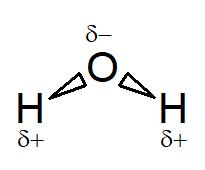
Struktur des Wassermoleküls mit Partialladungen
Struktur des Wassermoleküls mit Partialladungen δ+ und δ- am Wasserstoff bzw. am Sauerstoff mit einer Keildarstellung der chemischen Bindung zwischen den Atomen Wasserstoff und Sauerstoff. Dieser Keil deutet an, dass das Sauerstoffatom in der Bindung zum Wasserstoff die Bindungselektronen näher an sich heranzieht.
Eine Bindung, bei der zwischen den Bindungspartnern eine ungleiche Verteilung der Bindungselektronen vorliegt, bezeichnet man als polare Atombindung. Es existieren positive und negative Teilladungen in verschiedenen Bereichen des Wassermoleküls. Da das Wassermolekül eine gewinkelte Struktur besitzt (das liegt an den nichtbindenden Elektronenpaaren des Sauerstoffs), liegt der Ladungsschwerpunkt der positiven und negativen Teilladungen nicht übereinander, sondern getrennt voneinander. Es existieren ein positiver und ein negativer Pol, weshalb man beim Wassermolekül von einem Dipol spricht.
Das Dipolmolekül führt dazu, dass sich ein Wasserstrahl mit Hilfe einer positiven oder negativen Ladung elektrostatisch anziehen lässt. Reibt man einen Ballon oder einen Kunststoffstab an Wolle oder Haaren, so lädt sich der Kunststoffstab negativ auf.
Was passiert genau?
Bringt man Wassermoleküle in ein elektrostatisches Feld, so richtet sich das Molekül in dem Feld aus und der Wasserstrahl wird von dem Kunststoffstab angezogen.
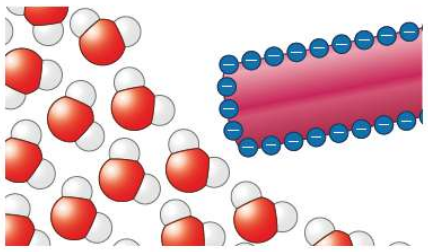
Bild 4: Modellvorstellung zur Ablenkung eines Wasserstrahls (Modelle der Wassermoleküle aus weißen (Wasserstoff) und roten (Sauerstoff) Atommodellen) durch einen negativ geladenen Kunststoffstab.
(© Cornelsen/Tom Menzel [2])
Diese Anziehung des einzelnen Wassermoleküls zeigt sich dann in der Ablenkung des Wasserstrahls.
Wie verhalten sich aber nun andere Flüssigkeiten in einem elektrostatischen Feld?
Hierzu kann man folgendes Experiment nutzen.
|
Experiment 2: Ablenkung von Flüssigkeiten durch ein elektrostatisches Feld Material: Stativmaterial, Bürette, Elektroskop, großes Becherglas, Trichter, Hartgummistab, Tierfell. Chemikalien: 1-Propanol, 1-Butanol, 1-Hexanol, Essigsäureethylester, Essigsäurepentylester, n-Octan, n-Pentan, n-Heptan, Ethanol (absolut. 99,8%), Essigsäure (99,5%), Wasser (destilliert), 2-Propanon (Aceton). Aufbau:
Bild 4a: Versuchsaufbau zur Ermittlung der Ablenkung von Flüssigkeiten durch Influenz. Links das eingesetzte Elektroskop mit aufgelegtem Hartgummistab.
Durchführung:
Bild 4b: Hartgummistab mit Katzenfell.
3. Die auf dem Elektroskop ablesbare Spannung soll für jede Flüssigkeit annähernd gleich sein. Der Zeigerausschlag sollte wie folgt vorliegen.
Bild 4c: Das eingesetzte Elektroskop mit aufgelegtem Hartgummistab.
4. Die Bürette öffnen und die Flüssigkeit im festgelegten Abstand am aufgeladenen Gummistab vorbeilaufen lassen. Beobachtungen:
Bild 5-13: Beobachtungen zu den unterschiedlichen Flüssigkeiten
Ergebnisse:
|
Es gibt also eine Reihe von Flüssigkeiten, die sich – unterschiedlich stark – elektrostatisch ablenken lassen.
Auffällig ist hierbei die Ablenkung von Alkanen und von Estern und dass die Ablenkung innerhalb einer homologen Reihe der Alkane und der Alkanole (vom Pentan zum Octan bzw. vom Ethanol zum Hexanol) zunimmt.
Warum werden auch unpolare Flüssigkeiten abgelenkt?
Nach der Betrachtung zum Wassermolekül und der Ableitung des Wassermoleküls als Dipol können wir bei den eingesetzten Flüssigkeiten mit Hilfe der EN-Werte und der Molekülstruktur polare und unpolare Bindungen unterscheiden. Je größer die Differenz der Elektronegativitäten (ΔEN) ist, desto polarer ist eine chemische Bindung.
EN (Wasserstoff) = 2,1
EN (Sauerstoff) = 3,5
EN (Kohlenstoff) = 2,5
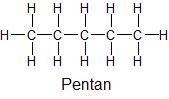
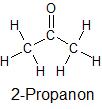
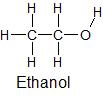
| Struktur und Name | Elektronegativitätsdifferenz (ΔEN) zwischen verschiedenen Atomsorten | Polarität innerhalb der Struktur einer Flüssigkeit |
|---|---|---|
|
EN (C) – EN (H) = 0,4 | unpolar |
|
EN (C) – EN (H) = 0,4 EN (O) – EN (C) = 1,0 |
wenig polar |
|
EN (C) – EN (H) = 0,4 EN (O) – EN (C) = 1,0 |
wenig polar |
|
EN (C) – EN (H) = 0,4 EN (O) – EN (C) = 1,0 EN (O) – EN (H) = 1,4 |
polar und unpolar |
|
EN (C) – EN (H) = 0,4 EN (O) – EN (C) = 1,0 EN (O) – EN (H) = 1,4 |
polar und unpolar |
|
EN (O) – EN (H) = 1,4 | polar |
Bild 14-19: Übersicht der Molekülstrukturen der verwendeten Flüssigkeiten
Die Alkohole, Essigsäure und Wasser werden stark abgelenkt, weil alle Stoffe in ihren Strukturen polare Bereiche besitzen. Diese Strukturen werden - wie schon beim Wasser erklärt - deshalb auch als Dipole bezeichnet.
Dass die anderen Flüssigkeiten auch schwach abgelenkt werden, liegt daran, dass auch unpolare Moleküle in einem elektrischen Feld polarisierbar sind. Das elektrische Feld stört die gleichmäßige Elektronenverteilung der unpolaren Bindung und erzeugt so ein kurzzeitiges Dipolmoment. Man spricht deshalb hierbei von induzierten Dipolmomenten. Die Ursache dieses Dipols liegt also nicht direkt in der Struktur. Vielmehr wird dem Stoff von außen ein Dipol sozusagen aufgezwungen.
Je stärker das den unpolaren Stoff umgebende elektrische Feld ist, desto stärker ist auch das induzierte Dipolmoment und je mehr Elektronen ein Molekül hat, desto leichter lässt sich ein induziertes Dipolmoment erzeugen [1].
Das bedeutet, dass jede Flüssigkeit oder auch Gase durch ein elektrisches Feld abgelenkt werden können. Das Maß der Ablenkung hängt nur von der Stärke des elektrischen Feldes ab, dass Dipolmomente in der Verbindung oder den betreffenden Atomen erzeugt.
Warum nimmt der Grad der Ablenkung innerhalb einer homologen Reihe zu?
In allen Versuchen wurde mit Hilfe des Elektroskops darauf geachtet, dass das elektrische Feld zur Ablenkung der Stoffe annähernd gleich stark ist. Die Erklärung der zunehmenden Ablenkung innerhalb einer homologen Reihe muss also in der zunehmenden Polarisierbarkeit der Stoffe mit wachsender Kohlenwasserstoffkette liegen. Eine Verlängerung der Kohlenstoffwasserstoffkette bei den Alkanen und den Alkanolen, wie auch bei den Estern führt zu einer größeren Anzahl an Elektronen, sodass das elektrische Feld größere Dipolmomente erzeugen kann.
Abschließend können wir noch festhalten, dass die Einteilung von Stoffen in polar/unpolar oder polarisierbar/nicht polarisierbar, eine Voraussetzung dafür ist, Stoffeigenschaften wie die Siede- und Schmelztemperatur oder die Lösemitteleigenschaften solcher Flüssigkeiten erklären zu können. Ohne dieses Verständnis lassen sich molekulare Wechselwirkungen wie die sogenannten Van-der-Waals Kräfte und Wasserstoffbrückenbindungen nicht erklären.
Quellen:
[1] Atkins, Peter W.; de Paula, Julio; Kurzlehrbuch Physikalische Chemie 4. Auflage; Wiley-VCH; 2008 Weinheim.
[2] Arnold, K.; Lüttgens, U.; Fokus Chemie 7/8; 1. Auflage; Cornelsen Verlag, 2016 Berlin
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 31. Oktober 2021, Fritz Franzke