Prof. Blumes Bildungsserver für Chemie
Tipp des Monats November 2022 (Tipp-Nr. 305)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Kalibrierung von pH-Metern im Schulalltag
Uwe Lüttgens
Wer viel misst, misst viel Mist – ein beliebter Spruch im Labor. Aber auch wer wenig misst, misst manchmal ganz schönen Mist. Zum Beispiel, wenn im experimentellen Chemieunterricht in der Schule die Chemie der Säuren und Basen zum Thema wird und die pH-Meter zum Einsatz kommen. Ein Beispiel aus dem Schulalltag: Bei sauren Lösungen wird in einer Gruppe ein pH-Wert von 8,3 angezeigt, mit einem klitzekleinen von den Schülerinnen und Schülern geschätzten Fehler von +/- 0,4. Die benachbarte Experimentalgruppe verortet den pH-Wert irgendwo zwischen 3,7 und 5,2. Genaueres lässt sich nicht sagen, da der Wert ständig schwankt. Vielleicht hast du ja selbst schon während eines Experiments geflucht, weil deine pH-Messung offensichtlich nicht richtig funktioniert, weil das teure pH-Messgerät ständig schwankende oder offensichtlich falsche Messwerte liefert, so dass man gar nicht vernünftig ablesen kann. Spätestens jetzt wird wahrscheinlich jedem klar: Mit den pH-Metern stimmt was nicht. Vielleicht mangelt es einfach an der richtigen Pflege der Glaselektrode? Oder vielleicht ist das pH-Meter vor Beginn des Experiments nicht kalibriert worden? Bild 1: Ein gut gepflegtes pH-Meter liefert reproduzierbar genaue pH-Werte.
Dieser Tipp des Monats beschäftigt sich mit der richtigen Kalibrierung von pH-Metern. Tipps zur Pflege von pH-Metern gibt es in unserem Angebot hier, einschließlich einer nützlichen Checkliste. Zurück zum Thema: Warum sollten wir, nachdem wir die Pflegetipps beachtet haben, vor dem eigentlichen Gebrauch das pH-Meter kalibrieren? Im schulischen Alltag ist die Frage rasch beantwortet: Da viele Gruppen diese empfindlichen Messgeräte nutzen, weiß niemand genau, was vorher mit ihnen passiert ist. Und wenn dies nicht bekannt ist, dann passiert, was passieren muss: Es wird einfach nur viel Mist gemessen! Wir erkennen zwei Summanden in der Gleichung: U0 ist das Standardpotenzial. Der zweite Summand ist ein Produkt, zum einen dem Quotienten R · T / n · F, dem sogenannten Nernst-Faktor, und zum zweiten aus dem natürlichen Logarithmus der Aktivität von Protonen ln aH+. Die Aktivität a des Wasserstoff-Ions H+ korrigiert den Wert für die Konzentration c dieses Teilchen in der sauren oder basischen Lösung ein wenig aufgrund seiner Hydratisierung, die die Beweglichkeit einschränkt. Bild 2: Die Glaselektrode ist von einer Quellschicht umgeben, in die H-Ionen eindringen können. Zuvor muss die Hydrathülle abgestreift werden, was mit einem Energieaufwand verbunden ist. Andere Ionen, z.B. Natrium-Ionen Na+ oder Kalium-Ionen K+, können nur in stark alkalischen Lösungen in diese Schicht diffundieren und so die Messung beeinflussen. Fachleute sprechen vom Alkalifehler bei der pH-Messung oberhalb von pH 12.
Diese Korrektur ist deshalb für korrekte Messungen einer Potenzialdifferenz U notwendig, weil sich die Spannung, die das pH-Meter auswertet, nicht aus der Konzentration der in einer wässrigen Lösung vorliegenden Ionen ergibt, sondern aus ihrer Aktivität a. Die – in unserem Falle positiv – geladenen Teilchen sind von einer Hydrathülle aus Wassermolekülen H2O umgeben. Wenn diese geladene „Wolke“, in deren Mitte das H+-Teilchen sitzt, auf die Glaselektrode des pH-Meters trifft, dann befreit sich das Proton von seiner Hydrathülle. Dazu wird ein wenig Energie benötigt, die den Messwert leicht verändert. Daher muss dieser Wert für die Konzentration angepasst, d.h. etwas verringert werden. Eingesetzt wird also in die Nernst-Gleichung statt der Konzentration c die Aktivität a der H+-Ionen. Falls dich interessiert, wie die Glaselektrode eines pH-Meters die Protonenkonzentration einer sauren oder basischen Lösung in ein elektrisches Signal „übersetzt“, damit auf der digitalen Anzeige der pH-Wert angezeigt wird, gibt es einen ausführlichen Tipp. Da sich der pH-Wert jeweils um 1 Einheit ändert, wenn sich die Konzentration der Wasserstoff-Ionen einer Lösung um den Faktor 10 ändert, muss der Nernst-Faktor mit ln(10) = 2,3026 multipliziert werden: Bild 3: Die Temperaturabhängigkeit hat deutlichen Einfluss auf den Nernst-Faktor.
Weicht die Temperatur für die pH-Messung deutlich von 20 °C ab, sollte dies bei der Kalibrierung berücksichtigt werden. In der Schulpraxis spielt dies jedoch wahrscheinlich keine große Rolle. Schauen wir uns den Zusammenhang zwischen gemessener Spannung an der Glaselektrode und dem tatsächlichen pH-Wert einmal genauer an: Meist ist eine pH-Elektrode so aufgebaut, dass sie bei einem pH-Wert von 7 einen Wert für die elektrische Spannung U von 0 mV abgeben sollte. Dies ist die sogenannte Nullpunktspannung. Da die real gemessene Spannung von dem idealen Wert abweichen kann, sollte bei einem pH-Wert von 7 kalibriert werden. Bild 4: Bei der Ein-Punkt-Kalibrierung wird der Nullpunkt auf pH 7 eingestellt. Um diesen pH-Wert herum sollte ein pH-Meter gute Ergebnisse liefern.
Eine Ein-Punkt-Kalibrierung liefert gute Werte um den pH-Wert von 7, bei Messungen in stärker sauren oder alkalischen Lösungen sollte ein pH-Meter genutzt werden, das eine Zwei-Punkt-Kalibrierung bietet, da die Genauigkeit der pH-Wert-Bestimmung höher ist. Damit kommen wir zur Steigung der Geraden: Mit jeder pH-Wert-Änderung um eine Einheit, z.B. von pH 4 auf pH 5 ändert sich die Spannung um den Nernst-Faktor von 58,16 mV – so die Theorie. Wird eine pH-Elektrode häufig verwendet oder schlecht gepflegt und altert entsprechend, ändert sich auch dieser Wert mit der Zeit. Bild 5: Bei einer Zwei-Punkt-Kalibrierung wird die Steilheit der Kalibriergeraden zusätzlich zur Nullpunktverschiebung verändert. Insbesondere für die Bestimmung des pH-Wertes stark sauer oder alkalischer Lösungen sollten Geräte verwendet werden, die zusätzlich zu einer Messung bei pH 7 bei einem zweiten pH-Wert von 4 oder 10 kalibriert werden.
Bei der Kalibrierung wird neben der Nullpunktspannung die Steigung der Kalibriergeraden so verändert, dass die gemessene Spannung dem tatsächlichen pH-Wert auf der Anzeige entspricht. Bei pH-Metern für den Schuleinsatz findet sich dazu meist eine oder zwei kleine Schrauben, die jeweils über Drehpotenziometer auf einer kleinen elektronischen Schaltung die Spannungswerte verschieben. Ist ein Mikroprozessor verbaut, wird das Verhältnis von pH-Wert zur Spannung, also der Quotient pH / U, für zwei Punkte der Kalibriergeraden elektronisch verändert. Bild 6: Farblich gekennzeichnete Kapseln erleichtern die Herstellung von gut zu unterscheidenden Pufferlösungen: Die grüne Lösung dient zur Kalibrierung bei pH 7,01, orange entspricht einem pH-Wert von 4,01, und blau liefert einen Wert von 10,01. Der Hersteller [1] empfiehlt, die frisch hergestellten Lösungen vor dem ersten Gebrauch drei Stunden stehen zu lassen.
Übrigens: Dein Wissen über Puffer kannst du bei uns hier auffrischen. Bild 7: Die Funktionstüchtigkeit eines pH-Meters sollte vor dem Einsatz durch Kalibrierung geprüft werden. Stellt sich nach kurzer Zeit kein stabiler Messwert ein, kann anhand der Checkliste vorgegangen werden.
Bild 8: Wenn eine Zwei-Punkt-Kalibrierung am pH-Meter möglich ist, finden sich am Gehäuse zwei kleine Einstellschrauben, eine für pH 7 (im Bild links) und eine für pH 4 oder 10 (im Bild rechts).
Bild 9: Für spätere Messungen im sauren Bereich wird bei pH 4 die zweite Kalibrierung durchgeführt, bei Messungen im basischen Bereich entsprechend bei pH 10.Bild 8: Wenn eine Zwei-Punkt-Kalibrierung am pH-Meter möglich ist, finden sich am Gehäuse zwei kleine Einstellschrauben, eine für pH 7 (im Bild links) und eine für pH 4 oder 10 (im Bild rechts).

(Foto: Lüttgens)
Ein wenig Theorie vorweg
Zur Erinnerung: Die Nernst-Gleichung beschreibt das Verhalten an der Glaselektrode eines pH-Meters: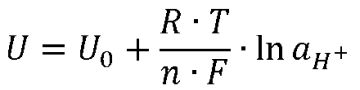
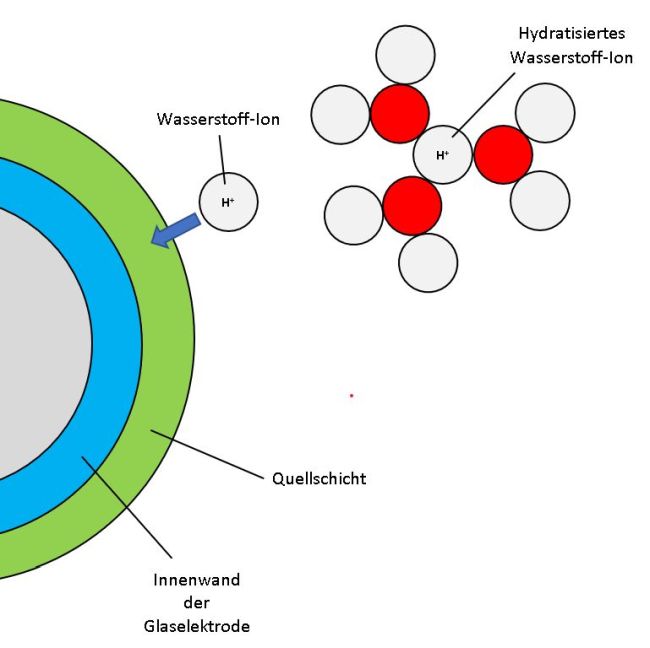
(Skizze: Lüttgens)
Der Nernst-Faktor bestimmt die am pH-Meter gemessene Spannung
Die allgemeine Gaskonstante R und die Faraday-Konstante haben, wie ihr Name schon sagt, feste Werte. Die kann man einfach im Tafelwerk nachschlagen. Der Wert für n ist 1, er ergibt sich aus der Ladung des Protons H+. Für eine Temperatur von 20 °C ist die absolute Temperatur von 293,15 K einzusetzen. Damit ergibt sich: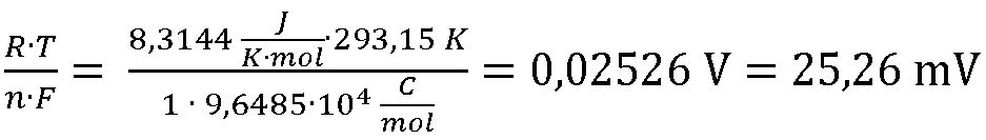
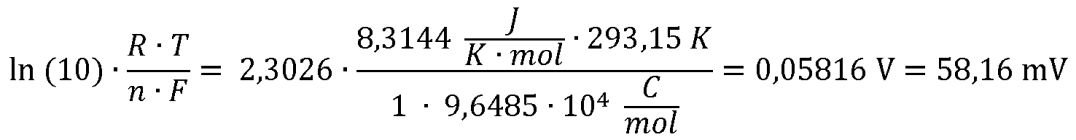
Der Nernst-Faktor ist von der Temperatur abhängig
Im Nernst-Faktor beeinflusst die Temperaturangabe die „Steilheit“ der für die Messung relevanten Geraden.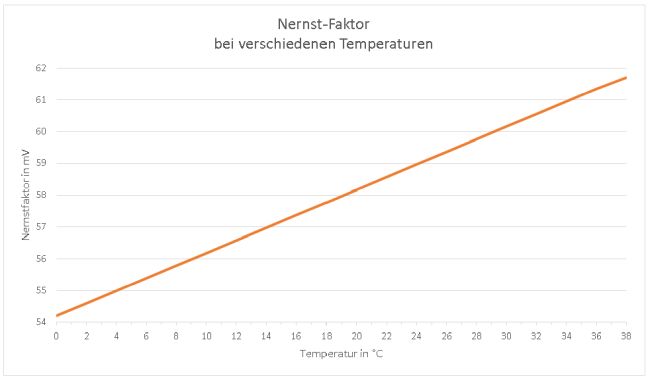
(Diagramm: Lüttgens)
Ideales Verhalten und reale Spannungen am pH-Meter
Die Änderung der gemessenen Potenzialdifferenz an der Glaselektrode erfolgt linear zur Änderung des pH-Wertes. Dies erkennen wir sofort, wenn wir uns die Nernst-Gleichung anschauen: Die Steigung m in der Geradengleichung y = mx + b entspricht dem Nernst-Faktor, x ergibt sich aus der Konzentration c bzw. Aktivität a und der Achsenabschnitt b wird durch U0 bestimmt. Umgestellt wird´s deutlich: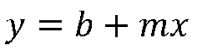
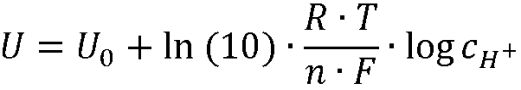
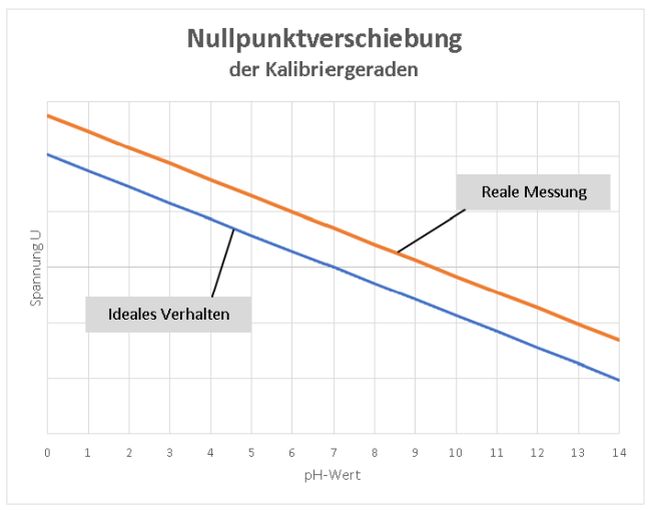
(Diagramm: Lüttgens)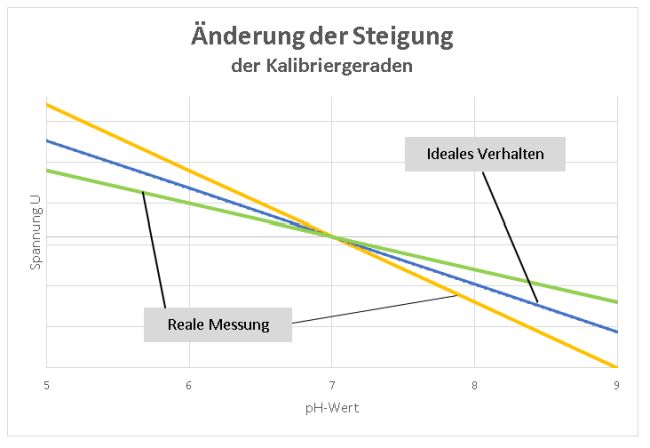
(Diagramm: Lüttgens)
Checkliste zur Kalibrierung
(Foto: Lüttgens)
(Foto: Lüttgens)
Nun zur Praxis:
(Foto: Lüttgens)

(Foto: Lüttgens)
Literatur:
[1] https://www.greisinger.de/files/upload/de/downloads/dokumente/Pufferloesungen.pdf (abgerufen am 11.10.2022)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 11. November 2022, Fritz Franzke