Prof. Blumes Tipp des Monats November 2011 (Tipp-Nr. 173)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Glaselektroden
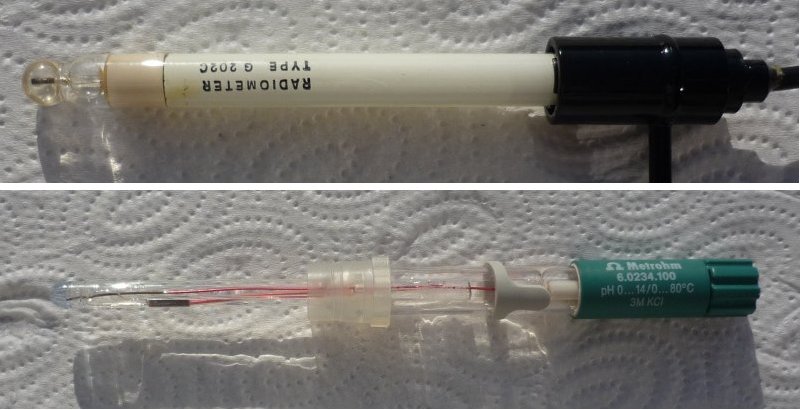
Bild 1: Glaselektroden.
Oben: Einzelelektrode, unten: Einstabmesskette
(Fotos: Blume)
Insgesamt ist es schon ein gewaltiger Fortschritt gewesen, als man in den 1950er Jahren die Glaselektroden eingeführt
hat. Endlich konnte man auf die unhandlichen und wegen des Wasserstoffs sogar gefährlichen
Standard-Wasserstoffelektroden verzichten. Aber auch die damals durchaus noch gängige
Chinhydron-Elektrode wurde abgelöst. Erinnert sei auch an manche pH-Elektroden auf
der Basis der pH-Abhängigkeit des Redoxpotentials von Metallen wie Antimon oder Bismut.
Dass Glas in Elektrolytlösungen elektrische Eigenschaften aufweist, war schon seit dem 19. Jahrhundert bekannt. Aber zu pH-Mess-Zwecken konnte man diesen Effekt erst nutzen, als es gelang, völlig stromfreie Potentialbestimmungen durchzuführen. Dazu bedurfte es vor allem der Erfindung der Elektronenröhren und (moderner) des Transistors.
Alle nutzen die Glaselektrode, aber kaum einer weiß, wie sie funktioniert.
Hier ist ein Beispiel für eine entsprechende Anfrage, die diese Webseite betrifft:
“Ich habe wie so viele vor mir eine Frage wegen meiner Facharbeit, ich habe das Thema "Gips ein Baustoff aus den Kohlekraftwerken" und habe auch schon relativ viel gefunden, aber noch eine präzise Frage an sie. Bei dem Modellversuch zum Kalkwaschverfahren was hat da die Glaselektrode für eine Funktion bzw. warum soll in die Kalkaufschlämmung Strom eingeleitet werden (ich vermute um freie reaktionsfähige Elektronen zu schaffen, oder?), aber ist die Glaselektrode an Gleich- oder Wechselstrom angeschlossen und mit wie viel Volt??“
Wenn überhaupt jemand über die Abläufe in der Glaselektrode nachdenkt, stellen sich ihm vor allem folgende Fragen:
„Woher weiß der Platindraht innen, was draußen in der Lösung los ist?“
Deshalb zunächst etwas zum Aufbau der Glaselektrode
Ihr Aufbau ist eigentlich ganz einfach: Man stelle sich ein Glasrohr oder besser ein Reagenzglas vor, dessen Boden aus einer
äußerst dünnen (und daher auch so empfindlichen!) Glasmembran besteht. Im Glas befindet sich eine Pufferlösung mit dem pH-Wert
um 7. In diese ragt eine Edelmetallelektrode, die nach außen hin zu einem Spannungsmessgerät führt.
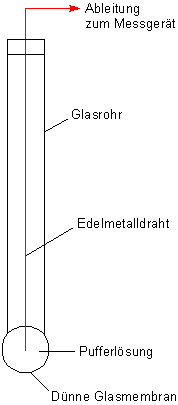

Bild 2: Aufbau einer Glaselektrode
(Foto: Blume)
Zur Messung benötigt man noch eine Bezugselektrode (auch Referenzelektrode genannt). Das ist eine
Elektrode II. Art mit nachgeschaltetem Gleichgewicht, deren Markenzeichen eine besonders gute Potentialstabilität ist.
Man verwendet dazu gern eine Silber/Silberchlorid-Elektrode in KCl-Lösung (c = 3 mol/l). Früher verwendete man stattdessen
eine gesättigte KCl-Lösung; da sich jedoch die Silberchloridelektrode in zu konzentrierter Chlorid-Lösung unter Komplexbildung
zersetzt, war das Potential dieser Elektrode nicht stabil genug.
In uralten Elektroden, die sicherlich noch in manchen Schulsammlungen zu finden sind, erkennt man im Bereich der Bezugselektrode Quecksilber. Es handelt sich um Kalomel-Elektroden. Ihre Zusammensetzung ist Hg/Kalomel (Hg2Cl2) mit KCl-Lösung als Elektrolyt.
Neuerdings setzt man vor allem auf Iod/Iodid-Elektroden.
Bei der Einstabelektrode fasst man im Glasrohr Glaselektrode und Bezugselektrode - natürlich räumlich streng getrennt - zu „einem Stab“ zusammen. Man spricht deshalb auch von Einstabmesskette. Man erkennt sie an einem dicken Koaxialkabel. Dieser Kabeltyp ist notwendig, um die gegenseitige Beeinflussung der Ableitungen durch besonders gute Abschirmung zu unterbinden.
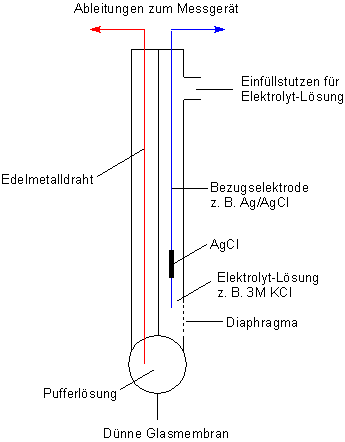

Bild 3: Aufbau einer Einstabmesskette
(Foto: Blume)
Die Einstabelektrode ist für den Nutzer besonders praktisch, da man keine zusätzliche Elektrode anzubringen hat. Man muss aber daran denken,
dass man immer Elektrolyt-Lösung nachfüllen muss. Das ist besonders deswegen wichtig, weil man bei der Messung den Einfüllstutzen
offen lassen sollte, um das Einströmen von Messlösung in den Elektrodenraum zu unterbinden.
Was bei der Messung molekular abläuft
Gleich vorneweg: Es findet kein Redoxprozess im eigentlichen Sinne statt. Deshalb sollte man die Kette gar nicht
erst mit einem Element wie z. B. auf der Basis von Cu/Cu2+ vergleichen. Dort war die gemessene Potentialdifferenz
abhängig von der Richtung des Elektronentransfers zwischen Metallen und ihren Anionen in Lösung. Bei der Einstabmesskette gilt
das nur für die Referenzelektrode.
Es wird auch kein elektrischer Strom durch die Lösung geschickt, wie der Fragesteller oben vermutet hat. Das ist typisch für Leitfähigkeitsmessungen.
Es ist auch wenig hilfreich, wenn man zur Erklärung der Funktion einer Glaselektrode von elektrischer Leitfähigkeit des Glases und dabei noch von Ionenaustauschereffekten spricht - denn Glas ist ein effektiver Isolator. Das ruft bei Vielen die falsche Vorstellung hervor, dass es durch das Glas Protonenwanderungen geben müsse, Ursache für die pH-Wert-Abhängigkeit des Potentials.
Um zu verstehen, wie die Glaselektrode funktioniert, muss man sich die Membran ansehen. Die besteht wie jedes übliche Glas aus Silicaten. Das ist ein Polyanion, welches Kationen zu adsorbieren vermag. (Man kann sie durchaus mit oberflächlich wirkenden Kationenaustauschern vergleichen.) Besonders wirksam sind die Polyanionen, wenn sie gut aufgequollen sind. Deshalb darf die Glaselektrode nicht eintrocknen. Die Oberfläche der Membran muss außerdem immer feucht gehalten werden, ist aber aus diesem Grunde auch besonders empfindlich. Letztlich muss man es sich so vorstellen, dass sich auf der Membran ein Pelz von H3O+-Ionen befindet. Dann folgt eine Schicht Anionen, dann wieder eine Protonenschicht usw.. Es bilden sich an der Innen- und an der Außenseite der Membran Ionen-Doppelschichten aus, die sich allerdings immer stärker verdünnen. Dass es diese wirklich gibt, hat man mit spektroskopischen Untersuchungen belegen können, bei denen ein dünner Lichtstrahl an der Elektrodenoberfläche streifend vorbeigeführt wurde.
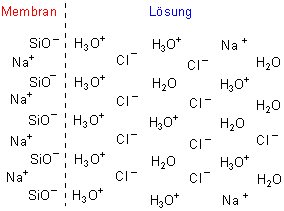
Bild 4: Schematische Darstellung der Ionen-Doppelschichten an einer Glasmembran
Wie entsteht ein Potential? Vielleicht hilft dieses fächerübergreifende Bild: Erinnern wir uns an die
Platten eines Kondensators, zwischen denen sich ein undurchlässiges Dielektrikum befindet: Das Aufbringen von
Ladungen auf die Kondensatorplatten führt zum Aufbau eines Potentials zwischen den Platten.
Fazit: Werden Protonen mit der umgebenden Lösung ausgetauscht, so verändert sich die elektrische Ladung der Membranoberfläche.
- Wenn viele Protonen in der angrenzenden Lösung enthalten sind, so werden entsprechend viele adsorbiert. Damit sinkt die negative
Oberflächenladung.
- Sind wenige Protonen in der Lösung, ist die Beladung der Membran geringer. Die negative Oberflächenladung ist größer.
Auf diese Weise unterscheiden sich die konstante Oberflächenladung an der Innenseite (mit der Pufferlösung) und die jeweilige Oberflächenladung an der Außenseite (mit der Messlösung). Dadurch baut sich ein Potential auf, das abhängig ist vom Unterschied der Protonen-Konzentrationen (besser: Protonen-Aktivitäten; siehe unten) innen und außen. Das nutzt man zur Bestimmung des pH-Werts aus, denn das Potential E ist eine Funktion des pH-Werts (siehe unten).
Man spricht von Membranpotential oder nach dem Entdecker von Donnan-Potential.
Auch für Membranpotentiale gibt es eine Nernstsche Gleichung
Wie schon gesagt: Zur Herleitung der Gleichung ist keinesfalls ein Redoxprozess heranzuziehen, wie z. B. bei einer normalen
Elektrode (z. B. für eine Kupferelektrode in einer Kupfersulfat-Lösung: Cu/Cu2+). Die Nernstsche Gleichung für das
Membranpotential lautet so:
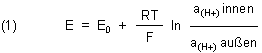
Der E0-Wert ist eine Materialkonstante – wie bei den „normalen“ Elektroden auch.
Zur endgültigen Erklärung des Potentials muss man thermodynamisch tiefer ansetzen. Die Gleichung von Donnan lässt sich nämlich wie auch die Nernstsche Gleichung durch die Betrachtung der Konzentrationsabhängigkeit der chemischen Potentiale (Symbol µ) der Ionen innen und außen der Membran herleiten.
Mit der Glaselektrode misst man keine Konzentrationen, sondern Aktivitäten
Oft stolpern Schüler über Abweichungen, wenn sie den gemessenen pH-Wert vom berechneten vergleichen. Da sind Unterschiede von
etwa 0,2 bis 0,5 pH-Einheiten durchaus möglich. Das resultiert daher, dass fälschlich mit Einwaagekonzentrationen gerechnet wird.
Das Stichwort lautet Aktivitäten.
Die Schilderung der molekularen Abläufe machte es deutlich: Erfasst werden durch die Messung nur die wirklich frei beweglichen Protonen. In der Lösung sind jedoch Protonen, die nicht frei beweglich sind, sondern in ihrer Beweglichkeit gehemmt sind - z. B. durch anziehende Wirkung der Anionen.
Wie sich das bei pH-Wert-Messungen bemerkbar macht, zeigt folgendes Beispiel. Nimmt man eine der Einwaage nach einmolare Lösung von Salzsäure, so misst man mit der für Protonen sensitiven und richtig geeichten Glaselektrode nicht den berechneten pH-Wert 0, sondern nur etwa 0,1. Die Lösung scheint weniger Protonen als die eingewogene Salzsäure zu enthalten, und das, obwohl die Salzsäure als starke Säure vollständig dissoziiert sein sollte. Die Protonen und die Chlorid-Ionen beeinflussen einander jedoch so stark, dass es bei dieser Art Messung und bei manchen chemischen Reaktionen den Anschein hat, die Säure sei schwächer als einmolar.
Je verdünnter die Lösungen der Säure werden, desto mehr nähern sich die Werte von Konzentration und Aktivität an, weil dann die Wechselwirkung zwischen ihren Ionen abnehmen.
Das Ganze ist noch von der Temperatur abhängig. Deshalb muss man bei der Messung mit Glaselektroden unbedingt auf die Temperatur achten und die entsprechenden Einstellungen am Gerät vornehmen.
Zum Handling einer Glaselektrode
Der Werkstoff Glas ist mechanisch und chemisch empfindlich. Für das Arbeiten mit einer
Elektrode gilt deshalb alles, was beim Arbeiten mit Glas zu beachten ist.
Sie ist mechanisch empfindlich, darf also nie mit einem Tuch abgetrocknet werden. Extreme pH-Werte (vor allem im alkalischen Bereich) sind zu vermeiden, da sie die Quellschicht der Membran ablösen. Wenn es doch mal passiert, kann man sie durch eintägiges Einlegen in eine verdünnte Salzsäure (maximal 1 mol/l) regenerieren. Anschließend muss die Elektrode neu geeicht werden.
Übrigens muss man auch immer dafür sorgen, dass das Diaphragma der Referenzelektrode sauber und durchlässig ist. Ist der ansonsten weiße Punkt in Bild 3 schwarz geworden, hilft etwas Schmirgeln - aber dabei bitte nicht die Membran berühren!
Gegen „versiffte“ Elektroden (z. B. durch Messungen in protein- oder fetthaltigen Mischungen wie Milch) hilft eine Behandlung mit Lösungen von Natriumdodecylsulfat (SDS). Das Tensid ist auch in Feinwaschmitteln wie Fewa® enthalten.
Zum Eichen der Glaselektrode
Nicht vergessen! Eine Glaselektrode muss regelmäßig geeicht werden.
Dazu muss man Pufferlösungen mit genau definierten Protonenaktivitäten verwenden ("Eichpuffer"). Also: Niemals eine Salzsäure oder Natronlauge, auch wenn sie aus käuflichen Ampullen vorschriftsgemäß hergestellt wurden, zum Eichen der Glaselektroden einsetzen (-> Aktivitätenbegriff)!
Statt der käuflichen Eichpuffer kann man sich zur Not auch Lösungen mit mittlerem pH-Wert selber herstellen. Am Besten nimmt man Lösungen mit maximaler Pufferwirkung, also Säure/Base-Systeme in der Nähe ihres pKa-Werts. Beispiel ist die 1:1-Mischung von Essigsäure und Natriumacetat (beide c = 0,1 mol/l).
Beim Eichen verschiebt man potentiometrisch die Kennlinie E = f(pH). Gleiches macht man auch, wenn man die Temperatureinstellung verändert.
Warum man die Lösung bei der pH-Messung rühren sollte
Wenn man pH-Messungen mit der Glaselektrode durchführt, stellt man fest, dass die Ergebnisse davon abhängen, ob man die Lösung rührt
oder nicht. Die Abweichung kann mehr als 0,3 pH-Einheiten ausmachen. Das Stichwort lautet Überspannung.
Überspannungseffekte gibt es überall, wo Ionen in einem elektrischen Feld wandern. Bei der Glaselektrode betrifft es die Ionenwanderung von und zu den Membranoberflächen und auch zur Bezugselektrode. Hier handelt es sich vor allem um die Diffusionsüberspannung.
Da die Überspannung auch eine Funktion der Entfernung der Kontaktstelle der Elektrodenräume ist, befindet sich das Diaphragma immer dicht neben der Glasmembran (siehe Bild).
Zur Eliminierung der Diffusionsüberspannung muss man darauf achten, dass sich die Ionen in der Lösung gleichmäßig im elektrischen Feld bewegen können und ihre Konzentration in allen Bereichen der Lösung immer konstant bleibt. Das wird z. B. durch gleichmäßiges Rühren gewährleistet - am Besten mit einem Magnetrührwerk mit Rührfisch. Es reicht schon aus, die Elektrode entsprechend zu bewegen.
Doch Vorsicht! Man sollte aber nie mit einer Glaselektrode rühren - z. B. um ein Salz zu lösen… Beim Rühren der Lösung mit einem Rührfisch muss man darauf achten, dass der Rührfisch nicht die Membran zerschlagen kann.
Ionensensitive Elektroden
Solche Elektroden reagieren nur auf bestimmte Ionenarten. Natürlich gehört dazu auch die Glaselektrode, die (wie wir gehört haben) ausschließlich
für H+-Ionen sensitiv ist. Es gibt aber auch Elektroden, die die Aktivitäten von Halogenid-Ionen spezifisch erfassen. Sie
funktionieren letztlich genauso wie eine Glaselektrode, nur dass die ionensensitive Membran aus einem schwerlöslichen Salz des
jeweiligen Ions hergestellt wird. So gibt es Kristallmembranen aus Silberchlorid (Chloridelektroden) oder Silberbromid (Bromidelektroden).
Fluoridelektroden enthalten in ihren Membranen Calcium- bzw. Magnesiumfluorid.

Bild 5: Fluoridsensitive Ionenelektrode
(Fotos: Blume)
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 08. Januar 2012, Dagmar Wiechoczek