
Bild 1 (Foto: Daggi und Jan) |
Prof. Blumes Tipp des Monats August 1997 (Tipp-Nr. 2)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Bild 1 (Foto: Daggi und Jan) |
Die gepufferte Schönheit des Rotkohlsafts oder
Wie man Rotkohlsaft kornblumenblau färbt
Mit Rotkohlsaft kann man bekanntlich schöne Farben zaubern. Seine Farbskala reicht von Rot über Lila nach Kornblumenblau und weiter über Grün nach Gelb. Bei den üblichen Vorschriften erhältst du nie die Farbe Blau, so dass die meisten gar nicht wissen, dass diese Farbe für den Farbstoff so typisch ist, dass man ihn Cyanidin genannt hat. Cyan kommt aus dem Griechischen und heißt nämlich "Blaugrün".
Zur Herstellung von Rotkohlsaft gibst du frische, zerkleinerte Rotkohlblätter in ein Becherglas mit Leitungswasser und kochst die Mischung einige Minuten, bis sich eine rote Lösung gebildet hat. Lasse abkühlen und filtriere ab. Danach kannst du den Saft verwenden.
Saft, den du nicht sofort verbrauchen willst, füllst du in kleine Gefäße oder Plastiktüten, die du dann einfrierst. Auch ein Kunststoffgefäß zur Bereitung von Eiswürfeln ist gut geeignet. So hast du immer kleine Portionen zur Hand.
Anwendungsbeispiele:
Im Schullabor:
Du stellst dir folgende Puffer-Lösungen (c = 0,1 mol/l) her (die pH-Werte sind nur näherungsweise einzuhalten): Essigsäure/Acetat pH 4,5; Phosphate 6/6,5/7; Hydrogencarbonat 7,5 und Soda 11,5 [Xi]. Außerdem benötigst du verdünnte Salzsäure, Natronlauge (jeweils c = 0,1 mol/l; [Xi]) und konzentriertere Natronlauge (c = 2 mol/l; [C]).
Gib davon jeweils gleiche Mengen (z. B. 5 ml) in Reagenzgläser. Tropfe jeweils gleiche Mengen Rotkohlsaft aus einer Tropfpipette bis zur ausreichenden Färbung hinzu. Kurz umschütteln. Wenn du alles richtig gemacht hast, erhältst du eine Farbreihe wie oben beschrieben. Stelle sie in einen Reagenzglasständer und betrachte sie gegen helles Licht. Lasse die Lösungen ruhig ein paar Tage stehen. Die stärker alkalischen Lösungen färben sich mit der Zeit tief gelb. (Hinweis: Wenn man zu verdünnte Alkalien nimmt, wird die Lösung nur grün. Das Gelbwerden dauert sowieso etwas länger. Also: Stehenlassen und warten! Gelb ist übrigens eine Farbe, die die irreversible Zerstörung des Farbstoffs anzeigt. Bei Zugabe von Säure wird er dann nicht wieder rot.)
Vereinfachte Pufferrezepte
Vereinfachte Pufferrezepte, die nur aus Soda und Natriumbicarbonat bestehen, sind denkbar (siehe Webseite).
Zu Hause im Küchenlabor:
| 1) | Du kannst die Farbreihe auch erhalten, wenn du in die Reagenzgläser jeweils folgende Lösungen füllst: |
| Umgekehrt kannst du durch Vergleich mit der obigen Pufferreihe feststellen, welchen pH-Wert deine Lösungen haben. |
| 3) | Mit dem Saft kannst du auch Lösungen von anderen Haushaltsmitteln und Lebensmitteln untersuchen. Vorsicht, wenn du mit Reinigungsmitteln umgehst! |
| 4) | Gieße zu einigen Millilitern Rotkohlsaft in ein breites Becherglas Mineralwasser
(Gerolsteiner) und rühre gut um. Die Farbe verändert sich langsam (etwa innerhalb von
10 min) von Rötlichviolett nach Blau. Du kannst das Ganze auch ohne umzurühren
stehen lassen; dann dauert die Umfärbung entsprechend länger.
Grund: Das Mineralwasser enthält Kohlensäure. Da das säurebildende Kohlenstoffdioxid ausgast, wird die Lösung zunehmend weniger sauer, der Indikator färbt sich um. |
Etwas zur Chemie und zur Biologie des Rotkohlfarbstoffs
Der Grund für die Farbveränderung ist, dass der Farbstoff ein Indikator ist. Dieser zeigt an, ob eine Lösung sauer, neutral oder alkalisch ("basisch") reagiert. Dieser Indikator hat sogar zwei Umschlagsbereiche, einen im Neutralen (pH 7) und einen oberhalb von pH 10, also im Alkalischen.
Cyanidin ist eine Farbsäure. Sein Molekül ist sehr kompliziert gebaut: Es hat zwei OH-Gruppen, die Protonen abgeben können. Darauf beruht der Farbwechsel der Lösung.
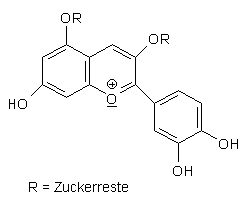
Die Blau- und Gelbfärbungen sind umkehrbar; dazu musst du Säure zugeben, die Lösung wird wieder rot. Die Grünfärbung ist eine Mischfarbe aus Blau und Gelb. Der gelbe Farbstoff wird allerdings langsam in einen anderen gelben Stoff überführt, der jedoch nicht mehr mit Säure zurück zu Blau oder Rot reagiert. Aus diesem Grunde kannst du gelbe Lösungen nach längerem Stehenlassen nicht mehr zu Blau zurückführen.
Der gleiche Farbstoff kommt auch in der roten Rose sowie in den Stockrosen und Hibiskus vor.

Bild 2 (Foto: Blume) |
Überraschend für dich ist wohl nicht, dass er zugleich der blaue Farbstoff der Kornblume ist. Das liegt aber nicht etwa daran, dass der pH-Wert in den Zellen der Kornblume ein anderer ist als der der roten Rose oder des Rotkohls. In der Kornblume ist der Farbstoff zusätzlich noch an dreiwertige Ionen wie Al3+ oder Fe3+ gebunden. Dadurch gibt es typische Farbverschiebungen. (Chemiker sprechen hier von Komplexbildung.) Das wissen übrigens auch die Gärtner: Rote Hortensien gießen sie deshalb während der Blütenentwicklung mit Lösungen von Aluminium- oder Eisensalzen; dann werden die Blüten nicht rot, sondern blau. Andere vergraben im Wurzelbereich rostige Nägel. Das hat die gleiche Wirkung. Versuch das auch mal.

Bild 3: Blaue Hortensie (Foto: Blume)
Jetzt kannst du überprüfen, ob der folgende Satz stimmt:
"Die buschigen Hortensien, die man häufig in englischen Seebädern findet, sind eine
Art lebendiges Lackmuspapier, mit dem man den Säuregrad von Flüssigkeiten bestimmen
kann. Die Blüten dieser Pflanzen ändern ihre Farbe je nachdem, wie stark der Boden
sauer oder alkalisch reagiert. Die Blütenfarbe variiert von dunkelrot über rosa bis
weiß, auf sauren Böden jedoch erscheint sie zunehmend blaustichig."
(Textstelle entnommen aus: Geheimnisse der Natur, Bertelsmann Lexikon-Verlag, Gütersloh/München 1992)
Antwort:
| 1. | Die Zellinhalte sind unabhängig vom pH-Wert des Bodens, auf dem die Pflanze wächst, immer gleich - nämlich schwach sauer. Dafür sorgen ausgeklügelte Puffersysteme. |
| 2. | Der Grad der Rot-Intensität (Tiefrot -> Rosa -> Weiß) ist unabhängig vom pH-Wert, sondern eine Frage des Farbstoffgehalts, also der Konzentration des Blütenfarbstoffs. |
| 3. | Säuren färben den Farbstoff zunehmend rot und nicht blau! |

Bild 4 (Foto: Daggi)
Zu den bunten Blumenfarben haben wir noch einen weiteren Tipp.
Rüdiger Blume