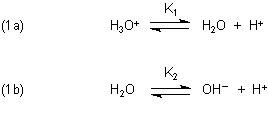
Wo liegen die pKa-Werte von Wasser?
Wasser ist eine amphotere Substanz. Geht man zur Beschreibung des Wassersystems von der zweibasigen Säure Hydronium-Ion H3O+ aus, so muss man zwei pKa-Werte in Betracht ziehen.
Schülern und Studierenden stoßen rasch auf folgendes Problem: In der Literatur gibt es diverse, scheinbar unterschiedliche Angaben.
In den meisten Tabellen findet man im Allgemeinen für pK1 den pH-Wert 0, für pK2 den pH-Wert 14. Manchmal wird in den Tabellen statt der beiden pKa-Werte auch nur das Ionenprodukt des Wassers angegeben. Andere Stellen nennen aber als Werte für pK1 = -1,743 und pK2 = 15,743.
Was ist nun richtig? Irgendwie stimmt alles. Man muss nur die Randbedingungen kennen. Das betrifft die Konzentration des Wassers. Wir wollen das hier zeigen.
Zunächst formulieren wir die Reaktionsgleichungen für die Dissoziationsgleichgewichte des Wassersystems, ausgehend vom Hydronium-Ion.
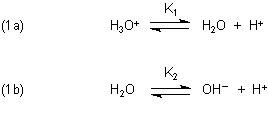
Die zugehörigen Dissoziationskonstanten K1 und K2 werden im Folgenden hergeleitet.
Die Konstante für das Gleichgewicht (1a) ist zunächst:
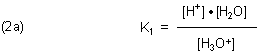
In der Konstante (2a) sind die Konzentrationen [H+] und [H3O+]
identisch. Damit reduziert sich die Konstante auf den erstaunlich einfachen Ausdruck (2b).

Die Konstante für das Gleichgewicht (1b) ist:
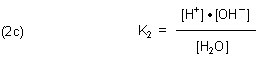
Wie schon angedeutet, enthalten all die zu Beginn zitierten pKa-Werte die Konzentration des
Wassers. Zum Beispiel kommen wir bei Berücksichtigung der Wasserkonzentration vom Ionenprodukt des Wassers (3)
letztlich auf die Dissoziationskonstante (2c). Den Zusammenhang zeigt die folgende Gleichung (4).
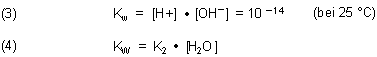
(Zur Temperaturabhängigkeit des Ionenprodukts von Wasser klicke hier.)
Um die Konzentration von Wasser in Wasser zu berechnen, muss man zunächst die Molzahl n von Wasser in einem Liter Wasser kennen. Die berechnet man so: 1 Liter Wasser wiegt bei 25 °C 997 g.
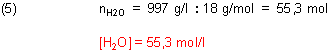
Wenn man nun die richtigen pKa-Werte berechnen will, muss man diese Konzentration berücksichtigen.
Zunächst die Berechnung von pK1. Wir gehen von Gleichung (2b) aus und logarithmieren sie.
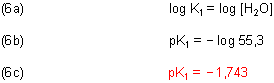
Das Gleiche gilt für die Berechnung von pK2 am anderen Ende der pH-Skala.
Zunächst logarithmieren wir auch die Gleichung (2c).
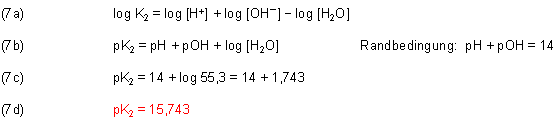
Zu diesem Ergebnis gelangt man auch, wenn man die Gleichungen (3) und (4) kombiniert und logarithmiert.
Die so definierten pKa-Werte des Wassersystems erklären die langen Pufferbereiche, die man bei
Säure/Base-Titrationskurven im stark sauren bzw. im stark alkalischen Bereich sieht.
Noch ein Hinweis: Egal, welche pKa-Werte man nimmt: Bei 25 °C und pH = 7 sind die Konzentrationen von H3O+ und von OH- gleich. Der pH-Wert dieses Punkts lässt sich ähnlich wie der Isoelektrische Punkt von Aminosäuren berechnen.

Schließlich sind Aminosäuren ja auch amphotere Stoffe - wie das Wasser.
Weitere Texte zum Thema „Wasser“