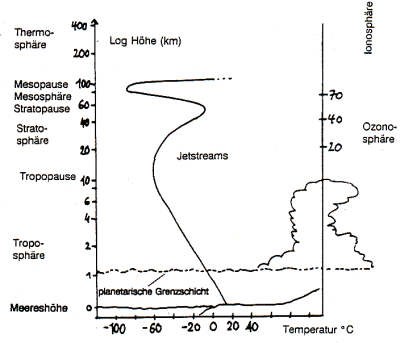
Abb. 1: Aufbau der Atmosphäre
Atmosphäre
Der Aufbau der Atmosphäre
Obgleich der Mensch nur in der untersten Luftschicht, der Troposphäre leben kann, ist auch die Atmosphäre bis zu einer Höhe von 1.000 km lebenswichtig. Den Gesamtaufbau der Atmosphäre zeigt Abb. 1.

Abb. 1: Aufbau der Atmosphäre
Man sollte erwarten, dass die Atmosphäre mit zunehmender Höhe abkühlt. Dagegen treten jedoch Zonen mit auffälligen positiven oder negativen Temperaturänderungen auf. An diesen so genannten "Pausen" trennt man die verschiedenen Sphären.
Die deutliche Erwärmung in der Stratosphäre, die auch die Ozonosphäre umfasst, resultiert aus molekularer Absorption von Sonnenstrahlung (vor allem UV, Licht, IR) sowie aus chemischen Prozessen (Oxidationen, Rekombinationen von Radikalen).
Die Abkühlung beim Durchlaufen der Mesosphäre liegt an der zunehmenden Verdünnung der Luft, so dass sich die Wärmezufuhr aufgrund der o. a. Prozesse kaum auswirkt.
In der hohen Atmosphäre beobachtet man bei den Luftmolekülen eine starke Zunahme an kinetischer Energie. Diese wird durch Stöße von Partikeln aus dem Sonnenwind angeregt. Die kinetische Energie der Gasteilchen wirkt sich als Wärme Q aus:
Ekin = ½ mv2 = Q
Wegen der sehr geringen Konzentration an Luftmolekülen resultiert hieraus keine messbare starke Erwärmung, obgleich man diese Zone als Thermosphäre bezeichnet. Dies ist eher kinetisch zu verstehen: Die Moleküle haben eine Bewegungsenergie, als wenn sie sich in einem Raum bei hoher Temperatur befänden.
Die natürliche, "reine" Trockenluft
Die Tabelle 1 gibt einen Überblick über die Zusammensetzung
der natürlichen Trockenluft (1 Vol% = 104 ppm = 107 ppb).
| Tabelle 1: Zusammensetzung der natürlichen Trockenluft | |
| N2 | 78,08 Vol% |
| O2 | 20,95 |
| Ar | 0,93 |
| CO2 | 0,034 (= 340 ppm) |
| Ne | 0,018 (= 180 ppm) |
| He | 0,0005 (= 5 ppm) |
| Methan | 0,00016 (= 1,6 ppm) |
| N2O | 0,00003 (= 300 ppb) |
Normale Luft enthält dazu noch Wasserdampf (je nach Luftdruck und Temperatur 1-5 %), Spurengase, Aerosole und andere Schwebeteilchen. Diese Werte sind nicht konstant, sondern variieren in letzter Zeit beträchtlich. So war der vorindustrielle Wert für CO2 0,026 Vol%. Man beobachtet z. Z. eine relative Steigerung von 0,3 - 0,4 %/a (d. h. 1,5 ppm) - mit steigender Tendenz. Bei Methan beträgt die relative Steigerung z. Z. 1-2 %/a. Die Konzentration von Distickstoffoxid (Lachgas) N2O nimmt ebenfalls zu: die Rate beträgt 0,2 %/a.
Die Bildung der modernen Atmosphäre
Zunächst war die Atmosphäre ausgesprochen inert, vom Milieu
her eher redoxneutral, etwas reduzierend.
Die Entwicklung in Richtung auf die gegenwärtige Atmosphäre begann vor ca. 3 Mia. Jahren. Im Wasser lebende Bakterien und Algen nutzen von da an die Fotosynthese zur chemischen Reduktion des reichlich vorhandenen CO2 zu Kohlenhydraten.
Der freigesetzte Sauerstoff (ein Zellgift) oxidierte zunächst im Meerwasser gelöste Eisen(II)-Verbindungen zu rotbraunem Eisen(III)-oxidhydroxid. Vor 1,8 Mia. Jahren war der Vorrat an Fe(II)-Verbindungen aufgebraucht. Der Sauerstoff reicherte sich im Wasser an und bedrohte das bislang an reduzierendes Milieu angepasste anaerobe Leben. Die "Erfindung" der Atmung durch mitochondrienartige Bakterien rettete das Leben durch Umstellung auf aerobe Prozesse.
Zugleich entwich der Sauerstoff in die Uratmosphäre. Damit konnte sich nach Urey aber auch die Ozonosphäre bilden, die das bis dahin von UV-Strahlung bombardierte und deshalb völlig leblose Land schützte und die Besiedlung des Landes durch zunächst primitive pflanzliche Lebensformen ermöglichte. Lies hierzu die Webseite Die Fotolyse von Wasser schützte die Ursuppe und frühe Lebensformen.
Emissionen und Immissionen
Emissionen sind luftfremde Belastungsstoffe, die in die
Atmosphäre gelangen.
Immissionen sind die auf Mensch, Tier,
Pflanze, Gebäude etc. einwirkenden, luftfremden Stoffe.
Die folgende Übersicht soll zeigen, dass Schadstoffemissionen nicht nur durch den Menschen, sondern auch natürlichen Ursprungs sind. Der Unterschied ist aber, dass letztere Schadstoffe nur gelegentlich und nicht, wie die anthropogenen, anhaltend und dazu noch in Ballungszentren freigesetzt werden.
a. Beispiele für natürliche Emissionen
Vulkanismus
Gewitter
Durch Blitze entstehen weltweit wesentlich mehr Stickoxide als
aus anthropogenen Quellen. Diese kann man bei trockenen
Gewittern riechen. Sie sind aber verdünnter als in unseren
Ballungszentren.
Sandstürme
Bekannt ist der rötliche Saharasand, der sich in Mitteleuropa
bei Südströmung niederschlägt. Aus Wüstensand besteht z. B.
der Lößboden Chinas.
Gischt-Aerosole
Diese Aerosole sind weltweit im Bereich der Brandungszonen
zu beobachten. Sie sind sehr salzhaltig.
Rauch-Aerosole
Die meisten Rauchaerosole bilden sich bei Waldbränden.
Natürliche Emissionen von Tieren und Pflanzen
| - | Lebewesen setzen stoffwechselbedingt CO2, H2S und eine Vielzahl von flüchtigen organischen Verbindungen (vor allem Terpene, Duftstoffe wie Sexuallockstoffe (Pheromone), aber auch kurzkettige Fettsäuren oder nach Früchten riechende Ester) frei. Beispiele sind auch CKW der Algen, Dimethylsulfid aus Algen, Methan als Produkt der Gärung in Wiederkäuermägen, aber auch als mikrobielle Ausgasungen von flachen Gewässern wie den Reisfeldern oder auftauenden Dauer(perma)frostböden. Auch das "Methaneis" auf dem Grund von Ozeanen lässt Schlimmes befürchten. |
| - | Distickstoffoxid N2O entsteht als Nebenprodukt der bakteriellen Stickstoff-Fixierung und Denitrifikation. |
| - | Bei bakteriellen Abbauprozessen (Tierhaltung, Mist, Gülle) entweichen Ammoniak und Amine. |
| - | Pflanzen setzen insbesondere Pollen frei. Diese wirken als Allergene, deren Wirkung durch Rußpartikel aus Fotosmog verstärkt wird. Dies ist wahrscheinlich eine Erklärung für die beobachtbare zunehmende Anfälligkeit gegen Pollenallergien. |
b. Anthropogene Emissionen
Es gibt heute ca. 65000 handelsübliche Chemikalien zu
kaufen. In der Luft kann man davon bereits mindestens 3000
sicher nachweisen. So gelangen in der BRD 1,5 Mio. t/a
organischer Verbindungen in die Atmosphäre, davon 105 t als
Benzindampf. Weitere Emissionen betreffen niedere Moleküle,
die vor allem bei Verbrennungsprozessen entstehen.
Über die Quellen der Luftverschmutzung gibt die Abb. 2 Auskunft.
Klick mich an!
 Quelle: Cornelsen
Quelle: Cornelsen
Abb. 2: Quellen der Luftverschmutzung
Chemische Umwandlung der Emissionen
Viele Stoffe unterliegen unter Einwirkung von UV-Strahlung, katalytisch wirkenden
Oberflächen von Salpetersäure-Eiskristallen und Radikalen chemischen
Umwandlungen, wobei noch schädlichere Stoffe, die sog.
Fotooxidantien, entstehen können. Ein Beispiel ist Ozon, das
sich aus NO2 und O2 bildet, wobei der treibende Motor dieser
Reaktion die Oxidation von Kohlenwasserstoffen, Lösemitteln
oder Kohlenmonoxid ist (siehe Webseite).
Immissionen
Der Umfang der Immissionen hängt stark vom Ort ab. So
sind die Konzentrationen von NOx, SO2 und CO in
Ballungsräumen 10-100mal größer als in ländlichen Gebieten.
Allerdings beobachtet man auch hier steigende Tendenz.
In welchem Umfang Emissionen als Immissionen auf Organismen und Umwelt einwirken können, hängt neben dem möglichen chemischen Abbau auch vom atmosphärischen Austausch und Transport von Emissionen ab.
Bodennahe Emissionen bleiben zunächst unterhalb einer Luftschicht, die die Wetterzone abtrennt, der Inversionsschicht. Darunter ist die Schichtung der Atmosphäre relativ stabil; es finden kaum Austauschvorgänge statt (austauscharme Wetterlagen, z. B. Fotosmog, Nebel im Tal, Fönlage). Darüber, ab der Wetterzone, beginnt der vertikale Transport in höhere Luftschichten, aber auch horizontale Verfrachtung.
Vertikaler Austausch zwischen Troposphäre und Stratosphäre wird durch Hoch-Tief-Wechselwirkungen oder aufsteigende Gewitterwolken hervorgerufen.
Die horizontale Verfrachtung erfolgt weltweit durch die Jetstreams in 10-30 km Höhe. Die radioaktive Wolke nach dem Reaktorunglück von Tschernobyl umrundete in 15 Tagen die Erde. Dabei erfolgt Verwirbelung und Transport in höhere Luftschichten. Hier ist die Persistenz sehr hoch, wenn die Stoffe schwer abbaubar sind (Staub aus Vulkanausbrüchen).
Luftschädigende Gase und die Chemie der
belasteten Atmosphäre
In den folgenden Abschnitten werden Gase behandelt, die bei
Diese Stoffe sind wegen ihrer Auswirkungen auf die Umwelt sowie auf die pflanzliche und tierische Gesundheit von besonderer Bedeutung. Es handelt sich dabei nicht nur um hochreaktive, sondern auch um scheinbar inerte Gase, die Quellgase.
Quellgase sind relativ reaktionsträge Umweltchemikalien, aus denen sich unter dem Einfluss von NOx, Sauerstoff und Strahlung reaktive, stark schädigende Stoffe (wie z. B. Atome von Wasserstoff, Chlor und Sauerstoff sowie das Hydroxylradikal HO·, das Perhydroxidradikal HO2· oder Säuren) bilden können.
Beispiele für Quellgase sind Kohlenmonoxid, Methan und andere Kohlenwasserstoffe, Schwefelwasserstoff, Schwefeldioxid, Ammoniak, halogenierte Kohlenwasserstoffe wie Methylenchlorid CH2Cl2 sowie Treibgase bzw. Kältemittel wie Frigen-11 (CFCl3).
In diesem Zusammenhang sollte auf die Zusammensetzung der Kfz-Abgase eingegangen werden. Diese sind, wie noch gezeigt wird, für die meisten Umweltschäden mit-, wenn nicht sogar hauptverantwortlich.
| Tabelle: Zusammensetzung der Kfz-Abgase | |
| CO2 | 9,0 Vol% |
| O2 | 4,0 |
| H2 | 2,0 |
| CO | 1,0 |
| NOx | 0,06-0,1 (abhängig von der Motorleistung) |
| SO2 | 0,006 |
| KW*) | 0,11 |
| Aldehyde | 0,04 |
| *) Kohlenwasserstoffe, werden auch CH abgekürzt. | |
Die Chemie der belasteten Atmosphäre
An dieser Stelle soll
vorausgreifend ein zusammenfassender Überblick über die
wichtigsten Vorgänge in der Atmosphäre gegeben werden. Dies betrifft
vor allem die Ozonbildung und -zerstörung, die Mechanismen
der Reaktionen von Fotooxidantien und von Radikalen sowie
die Entstehung des Sauren Regens. In den folgenden
Abschnitten dieser Webseiten-Sammlung wird im Einzelnen darauf eingegangen.
Die Abb. 3 zeigt ein stark vereinfachtes Schema der wichtigsten Stoffkreisläufe und Interaktionen der belasteten Atmosphäre. Die hier skizzierten Vorgänge bilden ein Multifaktorensystem, ein Beziehungsnetz von höchster Komplexität, wie man es eigentlich nur noch aus der Biochemie mit ihren vielschichtigen und vernetzten Stoffwechselprozessen kennt. So ist auch der Stoffwechsel der Atmosphäre in letzter Konsequenz noch nicht gänzlich verstanden. Hier liegt der Grund für die teilweise sehr kontroversen Diskussionen und Meinungen zum Thema Umwelt.
Solche Fließgleichgewichte sind von höchster Stabilität, weil sie sich normalerweise selbst zu regulieren vermögen und einzelne Einwirkungen im Sinne einer Abpufferung ohne große Gesamtänderung auffangen (Prinzip der Homöostasis). Größere Eingriffe können jedoch nicht mehr abgepuffert werden, es kommt dann zu umfassenden Veränderungen - vor allem in der chemischen Zusammensetzung sowie in der Temperaturänderung. Da man im Voraus nicht weiß, welcher Eingriff vom betreffenden Fließgleichgewicht noch toleriert werden kann, muss man experimentieren. Dies geht in der Biochemie relativ einfach: Man erforscht durch gezielte Eingriffe den Stoffwechsel an Versuchstieren, Mikroorganismen oder Zellkulturen. (Solche Erkenntnisse sind übrigens nur begrenzt auf den Menschen übertragbar.)
Für die Atmosphäre gibt es nur mathematische Modelle, deren Ergebnisse aber höchst geringe Wahrscheinlichkeiten und Aussagekraft haben. Eine große Rolle spielen dabei die sog. Fraktale: Wie löst z. B. der Flügelschlag eines Schmetterlings in Kolumbien einen Hurrikan im Golf von Mexiko aus?
Der Einstieg in das Flussdiagramm der Abb. 3 gelingt am besten, wenn man von der stratosphärischen Ozonbildung ausgeht. Ozon gelangt durch Umschichtungen in die Troposphäre, wo es mit der Bildung von Hydroxylradikalen HO· Stoffkreisläufe einleitet, die schließlich in die Entstehung von Saurem Regen und von Fotosmog münden.
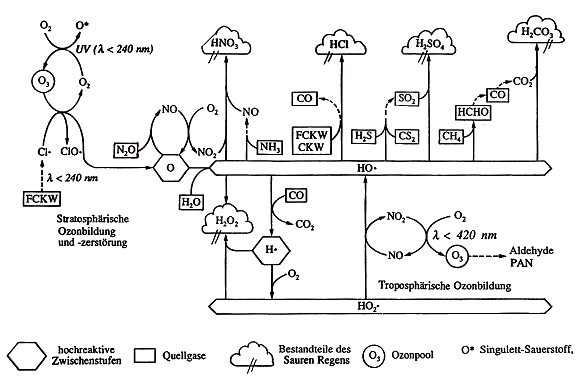
Abb. 3: Reaktionen in der belasteten Atmosphäre (vereinfacht nach [5])
Weitere Texte zum Thema „Abgas“