 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1501
F: Auch als Chemielehrer wird man bisweilen mit Schülerfragen konfrontiert, die
man nicht beantworten kann. So wollte ein Schüler in einer 9. Klasse wissen,
ob man in einer gesättigten Kochsalzlösung Zucker auflösen könnte. Das würde
mich auch interessieren!
A: Man kann. Aber das sollten Sie mit dem Schüler zusammen ausprobieren! Nehmen Sie
bitte Salz, das wirklich löslich ist. Viele Haushaltssalze haben Zusätze wie feinen Kalk, die die Rieselfähigkeit erhöhen sollen.
Zucker löst sich besser als Salz. Man kann kaum eine gesättigte Lösung von Zucker herstellen, denn der löst sich schier unendlich gut in Wasser.
Hinzu kommt die Konkurrenz um das Lösemittel Wasser. Es kann soweit kommen, dass zuvor gelöstes Salz wieder ausfällt, wenn man Zucker zugibt.
1502
F: Ich muss ein Mo-Schema von den Dihalogenen anfertigen (nur Valenzelektronen werden berücksichtigt).
Bei fluor und chlor hatte ich keine schwierigkeiten, da es sich ja vom sauerstoff ableiten lässt und man daran sehr schnell das Verfahren
erlernen kann. Nun kommen aber ab Brom d Orbitale dazu und ich habe nirgens etwas gefunden, dass mir Aufschluss darüber gibt wie sich
d-Orbitale im Mo-Schema darstellen lasse(wie viele Bindende oder antibindende Orbitale).
Es wäre sehr nett wenn sie mir weiterhelfen könnten(in der Uni Bib war ich
auch schon und habe einige Bücher erfolglos durchsucht)
A: Sie meinen ein MO-Schema. MO steht für Molekülorbital.
Die d-Orbitale spielen bei den Atombindungen des Broms keine Rolle. Früher gab es da die Theorie der Oktettaufweitung, man hat sie aber fallengelassen. Denn die d-Orbitale sind energetisch zu weit entfernt von s und p, als dass sie zur Bindung herangezogen werden könnten. Dazu haben wir die Frage 1450.
Analog zu den Schwefel- und Phosphorverbindungen gibt es auch bei der Formulierung der Halogen-O-Bindungen in Halogenoxiden mit höheren Oxidationsstufen und anderen Halogenoxoverbindungen (z. B. Säuren und deren Anionen) Probleme. So ist z. B. das Perchlorat-Anion tetraedrisch aufgebaut. Lösung: Die Bindungen sind polarisiert.
Man kommt also mit den s- und p-Atomorbitalen (AOs) sowie mit den s- und p-Bindungen bzw. den entsprechenden Molekülorbitalen (MOs) aus.
Anders ist es bei den Komplexen. Da spielen die d-Orbitale eine wichtige Rolle. Dazu sollten Sie sich mit der für Komplex-MOs gültigen Ligandenfeldtheorie befassen.
1503
F1: Ich benötige Ihre Hilfe. Was ist Molekularkinetik? Und wo bzw. wie wird sie
angewendet? Ich habe schon auf Ihren Seiten gestöbert aber direkt nichts dazu
gefunden. Unser Lehrer nannte die Formel E [kin]=1/2m*v².
Ich wäre Ihnen dankbar, wenn Sie mir schnellstmöglich eine Anwort geben könnten., da ich morgen eine Arbeit u.a. darüber schreibe.
A1: Molekularkinetik ist eine andere Bezeichnung für „Kinetische Gastheorie“, auf der die
„Ideale Gastheorie“ fußt. Letztere sollte man übrigens besser als „Theorie idealer Gase“ bezeichnen.
Die Postulate der kinetischen Gastheorie sind:
1 Gase bestehen aus Teilchen, die einen Raum ausfüllen. Ihr Eigenvolumen ist gegenüber dem Gasraum vernachlässigbar klein.
2 Zwischen den Teilchen gibt es keine Anziehungskräfte.
3 Die Gasteilchen befinden sich in schneller Bewegung. Sie stoßen „ideal“ zusammen und übertragen so verlustfrei ihre
Energie auf andere Teilchen – auch auf die Gefäßwand.
4 Die mittlere kinetische Energie hängt von der Temperatur ab.
Man führt verschiedene physikalische Effekte wie Wärme und Druck auf die temperaturabhängige Bewegung von Gasmolekülen zurück. Postulat: Die kinetische Energie der Moleküle entspricht letztlich der Wärme, der Impuls der Moleküle entspricht dem Druck. Der Denkansatz ist
Kinetische Energie pro Teilchen = Wärmeenergie pro Teilchen
Die Rechnung ergibt einen Zusammenhang zwischen Temperatur und der mittleren kinetischen Energie von Gasmolekülen. Hier ist für Spezialisten die Beziehung:
1/2 m • v2 = 3/2 k • T
(k ist die Boltzmann-Konstante. Das ist die Gaskonstante R / Loschmidtsche oder Avogadrosche Zahl;
T ist die absolute Temperatur in Kelvin.)
F1: Ich möchte mich noch mal ganz herzlich bei Ihnen bedanken. Ich bin in der 9.
Klasse des Gymnasiums und Chemie gehört nicht gerade zu meinen stärksten Fächern. Mein Vater hat mir den Tipp gegeben, mich
wegen meiner Frage an Sie zu wenden. Ich habe im Internet geschaut aber so direkt nichts darüber gefunden, zu mindest nicht so,
dass ich es verstehen. Wie Sie das geschrieben haben ist echt super. Ich habe es mir abgeschrieben und dann immer und immer wieder
durchgelesen. In der Arbeit konnte ich dann zu diesem Thema (hoffentlich! ;-) ) alles richtig beantworten. Ich werde ihnen schreiben,
wie die Arbeit ausgefallen ist. Also noch mal ganz vielen Dank für die tolle Hilfe. Irgendwie kann Chemie doch Spaß machen, wenn
man es versteht!!!
Also DANKE vielmals und bis demnächst, mit hoffentlich einer guten Note…
1504
F: Seit einiger Zeit habe ich Schwierigkeiten. Meine Haut an der Hand spannt oft, brennt, wird
rot und schwillt an. Sie entwickelt auch Pusteln. Ich meine, dass diese Symptome immer auftreten, wenn ich die alten Blätter einer
Topfprimel entferne.
A: Es handelt sich wohl um die Becherprimel (Primula obconica). Die habe ich auch im
Blumenfenster stehen.

(Foto: Blume)
Ich weiß, wovon Sie sprechen… Sie haben die Symptome einer Allergie, genauer einer Kontaktdermatitis (Frage 1454) entwickelt. Der Grund ist der Umgang mit diesen Blumen. Nicht umsonst heißen diese haarigen Biester "Juckprimel" oder auch „Giftprimel“. Auch der Name „Ekzemprimel“ ist zu lesen. Ihre Härchen enthalten einen reizenden Stoff. Reizend bedeutet hier „irritierend“ im medizinischen Sinne, also Dermatitis auslösend. Diese Primel müsste eigentlich das Gefahrensymbol Xi tragen:

Der Inhaltsstoff heißt Primin. Er zählt zu den stärksten natürlichen Kontaktdermatitis-Auslösern.
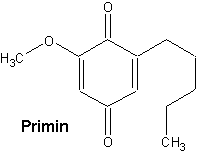
Es handelt sich um ein Benzochinon-Derivat. Die chemische Bezeichnung ist 2-Methoxy-6-pentyl-1,4-benzochinon. Letztlich stammt diese Verbindung aber von den Terpenen ab.
Mittlerweile kann man weniger irritierende Becherprimeln kaufen. Achten Sie auf den Vermerk „Touch Me-Serie“. Diese Primeln haben wir zwar auch ausprobiert. Aber nach den Erfahrungen damit ist mein Fazit: Ich persönlich werde wohl gar keine Pflanze dieser Art mehr kaufen, und das, obwohl sie das ganze Jahr hübsch blüht und sehr pflegeleicht ist. Denn auch diese „Rühr mich an-Serie“ ist nicht so ganz „ohne“, wenn man sich die Allergie erst einmal eingefangen hat. Da helfen nicht einmal Gummihandschuhe.
Was ist die biologische Rolle dieser Substanzen, warum hat die Pflanze sie entwickelt? Diese Stoffe wirken gegen Fressfeinde, vor allem gegen Insekten. Glücklicherweise sind die meisten Primeln jedoch harmlos – vor allem die Schlüsselblumen, die bei uns den Frühling einläuten.
1505
F: Heute mal zu einer Frage von Günter Jauch, die sicherlich den einen oder anderen an der
Chemie Interessierten beschäftigt hat:
Was besteht zu 90 % aus Aragonit und Calcit?
A Brillant
B Echte Perle
C Strass
D Bernstein
A: Die Antwort B ist richtig. Hierzu im Einzelnen:
Ein Brillant ist ein geschliffener Diamant. Der wiederum ist eine Modifikation des reinen Kohlenstoffs. Zum Brillantenschliff klicke hier.
Eine echte Perle ist ein biologischer Verbundstoff, der zu 90 % (und mehr) aus feinsten Calciumcarbonat-Plättchen, die in Proteine eingelagert sind, besteht. Vom Calciumcarbonat gibt es zwei Modifikationen, Aragonit und Calcit.
Strass ist eine Schmuckimitation aus Bleikristallglas. Er ist benannt nach dem Erfinder Georg Friedrich Strass,
der es um 1730 in Paris als Diamanten-Imitat herstellte. Die chemische Zusammensetzung kann variieren. Ein typisches
Bleiglas besteht aus 56 Gewichtsprozent SiO2, 32 % PbO, 11,4 % K2O, 0,1 % Al2O3
und 0,5 % As2O5.
Bleiglas zeichnet sich durch ein starkes Lichtbrechungsvermögen und dazu noch durch chemische und mechanische Stabilität aus. Aus
diesem Glas macht man deshalb nicht nur Schmuck, sondern auch Prunkgläser, Lüster und Linsen.
Die optische Wirkung von Strass wird erhöht, indem man seine Unterseite mit einem spiegelnden Überzug beschichtet. Außerdem bedampft
man es mit Metall, wodurch es zu changierenden Oberflächenfarben kommt.
Bernstein ist ein relativ weiches Mineral organischen Ursprungs. Er ist das fossile Harz von Nadelbäumen und viele Millionen Jahre alt.