 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1696
F: Ich beschäftige mich seit langem mit Experimenten für Kinder, da ich angehende
Erzieherinnen unterrichte. Mir geht es manchmal wie Kinder, die immer neue Fragen haben.
Ich habe ein Experiment gefunden, bei dem man kleine Teile (Rosinen, Linsen, ..) in kohlensäurehaltiges Wasser gibt.
Es sammeln sich Gasbläschen um die Linse, es kommt zum Auftrieb, ...
Meine Frage: Warum bilden sich die Luftbläschen (CO2) immer an Feststoffen aus?
Das gleiche ist zu beobachten, wenn man ein Glas Trinkwasser stehen lässt: Mit der Zeit haben sich am Glas - und nur da -
viele kleine Bläschen gebildet, Warum steigen sie nicht auf? Hängt das dann mit der Oberflächenspannung des Wassers zusammen?
A: Gelöstes Gas liegt im Wasser eingeschlossen
in kleine Käfige aus Wassermolekülen vor. Deshalb ist irgendwann mit dem Lösen Schluss: Wir sprechen von einer gesättigten Lösung.
Das Gas wird freigesetzt, wenn es durch zugesetzte Stoffe Konkurrenz um das Lösungsmittel Wasser gibt.
Wenn Sie Kristalle von Salz oder Zucker in Mineralwasser werfen, beobachten Sie die sofortige Bildung von Gas an den Kristalloberflächen. Grund: Salz bzw. Zucker wollen sich unbedingt lösen. Dazu entreißen sie dem gelösten Gas das Lösungswasser. Das kann nicht mehr in Lösung bleiben und tritt aus. Den gleichen Effekt können Sie deshalb auch mit einer sehr konzentrierten, filtrierten Salzlösung erreichen. Wenn Sie die in Mineralwasser gießen, wird in großen Mengen Gas frei.
Letztlich trifft das alles auch auf Rosinen und Linsen zu: Denn die geben beim Einwerfen ins Wasser lösliche Stoffe ab, was wir allerdings kaum sehen. Wenn das Gas, das sich unterhalb der Rosine oder Linse bildet, nicht entweichen kann, steigt das Teil auf.
Gleiches gilt für so genannt „aktive“ Stellen im Glas. Achten Sie mal darauf, wenn sich Sprudel, Sekt oder Bier im Glas befinden: Die aufsteigenden Gasperlen bilden sich immer an bestimmten Punkten. Das Gas entsteht da, wo das Glas (oftmals unsichtbar) angekratzt ist. Da Glas sich sehr wenig löst, bilden sich (verglichen mit dem Salz oder Zucker) auch relativ wenig Bläschen. Dass die so lange haften, liegt tatsächlich daran, dass hierbei die Oberflächenspannung an der Blasenwand mitwirkt. Die Blase klebt förmlich am Glas. Erst wenn der Auftrieb stärker ist als die Haftung, steigt die Blase auf. Das Sprudeln wird folglich durch Tenside (Spülmittel) gehemmt. Deshalb soll man Sektgläser nicht mit Geschirrspülmitteln behandeln.
Wenn man aber große Kratzer ins Glas ritzt, bildet sich auch viel Gas. Aus diesem Grund hat man die Böden von teuren Sektgläsern mechanisch aufgeraut. Man spricht vom Moussierpunkt, denn dort bildet sich besonders viel Gas. Durch das großflächige Aufrauen erfolgt die Gasbildung schön gleichmäßig.
Bei der Bildung von Gasblasen kommt noch ein anderer Effekt hinzu: Je kühler das Lösungswasser ist, desto mehr Gas wird gelöst. Wird das Wasser (oder Getränk) warm, so geht Gas aus seiner Lösung. Es bilden sich deshalb beim längeren Stehen Gasbläschen - aber deutlich an bevorzugten Stellen. Dazu braucht man kein Mineralwasser; es reicht schon die im Leitungswasser gelöste Luft aus.
Ein anderer Effekt wird deutlich, wenn man frische Blumen in eine Vase stellt. Dann bildet sich auch eine große Menge Gas an den Stängeln (siehe Bild). Das ist unter anderem auch Sauerstoff, der durch die pflanzliche Fotosynthese entsteht.

(Foto: Blume)
1697
F: Hallo!
Beim Besprechen einer Hausaufgabe sind bei mir im Unterricht Probleme aufgetreten die auch mein Lehrer bisher nicht klären konnte:
Für die Oxidation von Schwefeldioxid zu Schwefeltrioxid sollte das Massenwirkungsgesetz aufgestellt werden. Dabei gibt es zwei
verschiedene Reaktionsgleichungen:
(1) 2 SO2 + O2 <- -> 2 SO3
oder
(2) SO2 + 1/2 O2 <- -> SO3
Rechnet man jeweils die Gleichgewichtskonstanten aus, so erhält man im zweiten Fall die Wurzel der Konstante der ersten Reaktion.
Wie geht das - sollte doch bei gleicher Temperatur die Konstante ein und derselben Reaktion gleich sein!
Das Massenwirkungsgesetz besagt, dass egal bei welcher Ausgangskonzentration man eine Reaktion startet, sich das Gleichgewicht
(evtl. sehr langsam aber auch mal ganz schnell) einstellt.
Nun liegt aber rechnerisch das Gleichgewicht bei ein und derselben Reaktion ja scheinbar an unterschiedlicher Stelle. Je nach
Schreibweise kommt ein größerer oder kleinerer Wert heraus.
Wie ist K definiert? Dürfen nur ganzzahlige Vorfaktoren in einer Reaktionsgleichung auftauchen? Wie sind die Vorgaben?
A: Sie haben Recht.

Es handelt sich zwar um die gleiche Reaktion, aber um verschieden definierte Konstanten. Da gibt es keine Regeln und keine Vorgaben. Leider findet man beide Schreibweisen.
Grundsätzlich sind Gleichgewichtskonstanten keine universellen „Werte an sich“. Sie sind Hilfsgrößen, die die Voraussage und somit die Planung des Ablaufs von Reaktionen ermöglichen. Dabei bleibt es jedem Autor oder Chemiker selbst überlassen, wie er „seine“ Gleichgewichtskonstante formuliert. Hauptsache, er bleibt für seine Zwecke immer beim gleichen gedanklichen Ansatz. Wenn er die so berechneten Werte publiziert, sollte er dazu allerdings schreiben, wie der zugehörige chemische Prozess (also letztlich die Reaktionsgleichung) aussieht.
Übrigens ist die Schreibweise der Reaktionsgleichung mit ½ O2 nicht überall gern gesehen. Sie hat aber den Vorteil, dass man statt des so genannten „Formelumsatzes“ (bei dem die Reaktionsgleichung mit ganzzahligen stöchiometrischen Faktoren benutzt wird) die Reaktionsenthalpie auf 1 Mol des Produkts beziehen kann und so z. B. energetische Vergleiche anstellen kann - wie etwa bei der Oxidation von Schwefel (Formel S8) zu SO2 und dann weiter zu SO3.
Statt der „Formelumsätze“
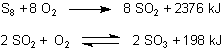
schreibt man besser diese auf 1 Mol Produkt bezogenen Gleichungen
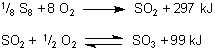
Nur den letzten beiden Gleichungen können wir auf dem ersten Blick hin entnehmen, dass eine direkte Oxidation von S8 zu SO3 nicht möglich ist, weil die Energie, die bei der Synthese der ersten Oxidationsstufe SO2 frei wird, größer ist als diejenige Energie, die zur Synthese von SO3 führt. Klicke hier.
1698
F1: In einem älteren Anleitungsbuch wollte man den Jugendlichen weismachen, dass ein
Wasserstrahl bei Annäherung eines geriebenen Kunststofflineals abgelenkt wird, weil Wassermoleküle Dipole sind - auch so ein
alter Zopf. Flüssiges Paraffin wird noch kräftiger vom Lineal angezogen, und wo bitte sind da Dipole? Ich möchte eher Influenz
als Ursache benennen.)
Mit freundlichen Grüßen
O. S. (immer wieder Konsument Ihrer Homepage!)
A1: Sie meinen offensichtlich, dass es sich bei den Wassermolekülen nicht um permanente
Dipole handelt, sondern dass diese erst durch Beeinflussung von außen Dipole bilden. Tatsächlich beruhen die meisten Messungen
darauf, dass die Moleküle auf äußere Ladungsänderungen „antworten“ - also Influenz zeigen. Das gilt für das Verhalten im
elektrischen Feld und letztlich deshalb auch für spektroskopische Daten.
Ich muss gestehen: Den Versuch mit dem Wasserstrahl habe ich ebenfalls entsprechend genutzt. (Hier zum Beispiel….) Zum Vergleich habe ich immer einen Benzinstrahl aus einer Bürette auslaufen lassen - er ließ sich nicht ablenken. Deshalb kann ich Ihren Versuch mit dem Paraffin nicht nachvollziehen. Ist es wirklich reines Paraffinöl? Vielleicht muss man auch noch über die Qualität des geriebenen Lineals nachdenken. Naturwissenschaftler meinen, dass man hier besser standardisieren sollte…
Zur Ablenkung des Wasserstrahls trägt sicherlich die Influenz bei. Diese ist letztlich auf das Vorhandensein von verschiebbaren elektrischen Ladungen im Molekül zurückzuführen.
Zwar beobachtet man diese molekulare Influenz auch bei unpolaren Molekülen - aber nur in sehr geringem Umfang. Sie gilt ja als Ursache der van der Waals-Bindungen. Diese spielen eine Rolle beim Zusammenhalt von unpolaren Kohlenwasserstoffen.
Bei den stark polaren Wassermolekülen, die dazu noch freie (nichtbindende) Elektronenpaare haben, können die Ladungen viel leichter verschoben werden.
Nun wird der Dipolcharakter des Wassermoleküls nicht nur durch den Ablenkungsversuch „bewiesen“, sondern auch durch andere Messungen - wie zum Beispiel die Bestimmung der ungewöhnlich hohen Dielektrizitätskonstante (80 Debye) von Wasser. Naja, auch hier legt man ein elektrisches Feld an…
Dennoch spricht vieles dafür, dass die Wassermoleküle reale permanente elektrische Dipole mit einem großen Dipolmoment sind. Das liegt daran, dass aufgrund der Elektronegativität die Bindungselektronen („induktiver Effekt“) stärker zum O-Atom gezogen werden als zu den H-Atomen. Weiter spielen auch die nichtbindenden Elektronenpaare am O-Atom eine entsprechende Rolle. Man kann die Eigenschaften solcher Dipolmoleküle mit Hilfe der mathematischen Methoden der Theoretischen Chemie berechnen, wobei man die Betrachtung von Zuständen mit besonders niedrigem Potential („Grundzustände“) in den Vordergrund stellt.
F2: Im Falle des flüssigen Paraffins habe ich ganz einfach einen geriebenen
Kunststoffstab einem größeren Paraffintropfen genähert: Es lösten sich kleine Paraffintröpfchen ab (zäh, wegen der Viskosität)
und flogen den Kunststoffstab an, an dem sie aufprallten und kleben blieben. Das Paraffin war rein (medizinisch).
Auch Benzin wird angezogen, sogar ein Benzinstrahl lässt sich eindeutig ablenken. Ich verwendete eine eingespannte
30ml-Kunststoffspritze mit verengtem Ausfluss. Der Benzinstrahl sollte so dünn wie möglich sein, am besten so, dass er
gerade noch nicht in Tropfen zerfällt. Ein Strahl aus einer Bürette ist zu dick. Eine Ausflussöffnung von unter 1mm
Durchmesser ist günstig und lässt dem Experimentator genug Zeit, nach dem Füllen der Spritze (Kolben entfernen, Benzin
einfach oben eingießen) einen Kunststoffstab durch Reiben aufzuladen und in die Nähe des auslaufenden Benzins zu halten.
Ich hatte Hart-PVC (gerieben mit Wolle, negative Ladung) und Acryl (gerieben mit Zeitungspapier, positive Ladung - Art der
Ladung wurde via Glimmlampe überprüft) getestet: In beiden Fällen eindeutige Strahlablenkung, bis über den Rand des Auffanggefäßes
hinweg möglich, wenn auch schwächer als bei einem Wasserstrahl.
Auch einzelne Benzintropfen "fliegen" den Kunststoffstab an; auf einer Benzinlache führt der angenäherte Stab zur Bildung
eines kleinen Flüssigkeitsbergs.
Das Benzin war ebenfalls frei von Verunreinigungen (Wundbenzin).
Aber wie Sie schon festgestellt haben: Mit Wasser sind diese Versuche sehr viel eindrucksvoller.
A2: Danke für Hinweise und für die Erläuterung Ihrer wirklich subtilen Experimente,
die Sie als einen Anhänger der „Alten Schule“ ausweist. Wenn Sie nichts dagegen haben, werde ich Ihre Anregungen mit in meine
Sammlung aufnehmen!
1699
F1: Zunächst einmal möchte ich bei Ihnen bedanken, für Ihre außergewöhnliche Internetseite.
Als naturwissenschaftlich interessierter Schüler der Oberstufe, bin ich begeistert von Ihrem Angebot, jedoch schreibe ich Ihnen
nun zum ersten Mal eine Mail zu einer Frage von mir.
Es geht um den Landoltschen Zeitversuch (in seiner wohl ursprünglichen Fassung).
In einer Versuchsanordnung soll man zunächst 8,5g Kaliumiodat in 2l Wasser lösen.
In einer zweiten Lösung sollen 1,16g Natriumsulfit, 1,00g Salicylsäure, 10ml Ethanol (c=96%) und 4,00g konz. Schwefelsäure gelöst werden.
Die dritte ist eine Lösung aus 100ml dest. Wasser und 5g wasserlöslicher Stärke.
Meine Frage ist nun weshalb in der zweiten Lösung die Stoffe Salicylsäure und Ethanol verwendet werden. Der Einsatz von Ethanol als Lösungsmittel scheint mir zum Beispiel in diesem Fall unnötig. Für die Salicylsäure habe ich mir überlegt, dass sie wohl eingesetzt wird um die Lösung zu stabilisieren, kann aber diesbezüglich keine genauere Funktionsweise angeben.
A1: Es ist tatsächlich so, dass man Salicylsäure und Ethanol gar nicht gebraucht. Ich
vermute, dass es sich bei Landolt um eine Zufallsentdeckung handelte, als er z. B. Salicylsäure iodieren wollte. Danach ist das
Rezept nicht geändert worden.
F2: Vielen Dank für Ihre Antwort. Was ich bei der Versuchsdurchführung gestern nur
beobachten konnte war, dass unter Einsatz von Salicylsäure bessere Ergebnisse erzielt werden können.
A2: Es ist tatsächlich denkbar, dass Salicylsäure einen moderierenden Effekt auf die
Redoxreaktionen hat. So etwas kennt man von Redoxmessungen an organischen Substanzen. Dazu bedarf es so genannter Mediatoren,
die katalytisch wirken.
1700
F: Auf Ihren hervorragenden Webseiten zu Kunststoff fand ich eine Bemerkung, die nach
meiner Information nicht richtig ist:
Auf grundsch/versuche/gs-v-073.htm wird geschrieben, dass Legosteine®
aus Polystyrol PS sind, nach meinem Kenntnisstand sind sie aber aus ABS (und das ist nur mit Trichlormethan zu kleben). ABS
ist als Copolymer ein eigenständiger Kunststoff. Heute werden wohl auch z. T. Bauteile aus Macrolon® verwendet.
Ansonsten: SUPER! Ich finde hier immer mal wieder Anregungen für Vorträge und selbst das Training von Ingenieuren (die meistens von Kunststoff nicht viel Ahnung haben). Vielen Dank für diese tollen Webseiten!
A: Sie haben Recht. Es muss heißen, dass Styrol als ein
Polymerisations-Edukt eingesetzt wird. Genau genommen handelt es sich um den
Kunststoff ABS, also um ein Copolymerisat von Acrylnitril, Butadien
und Styrol. Früher nahm man zur Herstellung der Legosteine® den Celluloseester Celluloseacetat.
Neuerdings setzt man Polycarbonat ein - Handelsname Macrolon®.
Macrolon® und ABS lösen sich nur in Lösemitteln wie Chloroform, einer krebsverdächtigen Substanz. Die sind dann auch in
deren Klebern enthalten. Das unterscheidet diese Kunststoffe von Polystyrol: Letzteres löst sich bestens in ungiftigem
Essigsäureethylester (bekannt als Nitroverdünnung oder Essigester), so dass man reines PS mit klassischem UHU® kleben kann.