Physikalische Eigenschaften der Alkohole - Eine Frage der Isomerie
Experimente:
Versuch: Siedepunkte von Butanol-Isomeren
Hat ein Alkohol mehrere Möglichkeiten, seine OH-Gruppe anzuordnen, so bildet er
isomere Verbindungen. Die enthalten Moleküle, die zwar die gleiche
Summenformel haben, aber bei denen die Atome unterschiedlich verknüpft sind.
Mit steigender Kettenlänge nimmt die Anzahl der isomeren Moleküle exponentiell zu.
Die einfachsten Beispiele sind Propanol und Butanol.
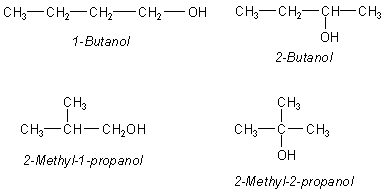
Propanol bildet bereits zwei Isomere. Butanol ist der erste Alkohol der homologen Reihe, der aufgrund seiner Kettenlänge alle drei Isomeren-Formen aufweist. An ihm kann man die verschiedenen Strukturen gut veranschaulichen.
Je nachdem, wie die Hydroxylgruppe des Alkohols gebunden ist, unterscheidet man zwischen
primären, sekundären und tertiären Alkoholen.
Die Bezeichnungen "primär, sekundär und tertiär" beschreiben die Anzahl der Alkylreste, die
an dem Kohlenstoff mit der OH-Gruppe hängen.

Die vier isomeren Butanole
Etwas ungenauer spricht man auch von Normal-Alkohol (n-Butanol) oder Iso-Alkoholen (i-Butanol).
Isomerie und Moleküleigenschaften
Zwar haben die isomeren Verbindungen die gleiche elementare Zusammensetzung und auch die gleiche
Molekülmasse, aber sie besitzen unterschiedliche Strukturformeln. Manche weisen deshalb auch verschiedene
chemische und physikalische Eigenschaften auf. Es spielt also eine entscheidende Rolle, um welches der
Isomere es sich handelt. Butanol ist eben nicht gleich Butanol! Die Isomere
unterscheiden sich deutlich voneinander, wenn man z. B. die Siede- und Schmelzpunkte oder auch die
Dichte betrachtet.
Unverzweigte, also primäre Alkohole, haben die höchsten Siede- und Schmelzpunkte. Mit der großen Oberfläche ihrer gestreckten Molekülform haben sie optimale Möglichkeiten, van-der-Waals-Kräfte zwischen den Kohlenwasserstoffresten auszubilden. Es ist deshalb energetisch aufwendiger, sie voneinander zu trennen.
Anders ist es bei den kugelförmigen Molekülen wie dem Iso-Butanol.
Was die Alkohole "wert" sind...
Wichtig ist, dass man die Begriffe primär, sekundär und tertiär nicht mit ein-, zwei- und
dreiwertig verwechselt. Mit den ersteren Begriffen wird die Art bzw. Stellung der OH-Gruppe angegeben.
Die Wertigkeit bezeichnet hingegen die Anzahl der OH-Gruppen in einem Molekül.
Alkohole mit einer OH-Gruppe bezeichnet man als einwertig, solche mit zwei oder drei Hydroxylgruppen als zwei- bzw. dreiwertig. Glykol ist beispielsweise ein zweiwertiger, und Glycerin ein dreiwertiger Alkohol. Es gibt auch Alkohole mit vier oder mehreren OH-Gruppen, die dann allgemein als mehrwertig bzw. als Polyalkohole (oder Polyole) bezeichnet werden.
Je mehrwertiger ein Alkohol ist, desto höher sind auch seine Siede- und Schmelzpunkte. Auch die Viskosität
nimmt mit der Anzahl der Hydroxylgruppen zu. Glykol und Glycerin sind beide bereits deutlich zähflüssig - Glycerin
mehr als Glykol.
Xylit, ein fünfwertiger Alkohol, und Sorbit, ein sechswertiger Alkohol, sind sogar Feststoffe. Dies zeigt, dass
es starke molekulare Kräfte zwischen den Molekülen geben muss. Dies liegt an den OH-Gruppen und den
Wasserstoffbrückenbindungen, die sie ausbilden können. Je mehr es davon gibt,
desto eher ist der Zusammenhalt zwischen den Molekülen garantiert.
Gibt es auch chemische Unterschiede zwischen den Isomeren?
Darüber berichten wir in einer gesonderten Webseite.
Weitere Texte zum Thema „Alkohol“