Prof. Blumes Tipp des Monats März 2004 (Tipp-Nr. 81)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Ockerfarbene Pigmente aus grünem Salz
Ein wesentliches Gebiet der modernen Chemie ist die Farbenherstellung. Das war
früher nicht anders: Als es noch gar keine Chemiker im heutigen Sinne gab und man
nur Alchimisten kannte, die sich mit dem Stein der Weisen abmühten, war die
Zubereitung von Farben schon Alltagsgeschäft vieler Handwerker.
Vor allem auch Kunstmaler haben sich ihre Pigmente zum Anrühren der Ölfarben
selbst hergestellt. Das machten sie nicht aus Geiz, sondern schon deshalb, um ja
genau denjenigen Farbton, den sie sahen oder sich vorstellten, richtig
hinzubekommen.
Farben wurden gemörsert und geschwemmt
Relativ einfach war das, wenn die Maler von fertigen Stoffen wie Bleiglätte (gelbes
Blei(II)-oxid) oder Bleiweiß (basisches Bleicarbonat) ausgingen. Diese Farbstoffe
mussten vor dem Dispergieren im Öl "nur" feinst zerteilt werden. In dem Roman "Das
Mädchen mit dem Perlohrring" von Tracy Chevalier (Econ Ullstein List Verlag,
München 2000) wird das Drumherum ausführlich geschildert. Das Buch handelt von
dem niederländischen Maler Jan Vermeer (1632-1675), über dessen Werk und
Alltagsleben die Autorin liebevoll berichtet. Vermeer war bekannt für seine Malerei des
lichterfüllten Innenraums, die in ihrem farbigen Tonreichtum nicht überboten werden
konnte. Hinzu kamen Lichtreflexe mit all ihrer Farbenvielfalt, die damals allein nur er so
gestalten konnte.
Zuerst mussten die Ausgangssubstanzen für die Farbstoffe "zerstoßen" (gemörsert) werden. Dann spülte der Maler (oder in dem Roman seine Gehilfin Grieth) sie viele Male, bis alle groben Teile zurückblieben und alle Unreinheiten ausgeschwemmt waren. Je feiner sie die Substanzen mahlte und je besser sie sie anschließend spülte, desto reiner und klarer wurden die Farbtöne, die man nach dem Mischen mit Leinöl erzielte: "Aus den groben, matten Körnchen Krapp wurde ein feines, leuchtendrotes Pulver und, mit Leinöl angerührt, ein funkelndes Rot. Es kam mir immer wie ein Wunder vor, wenn ich das machte".
Ein besonders schönes Beispiel für die Anwendung dieser Schwemmmethode ist die Aufarbeitung von Lapislazuli bzw. von dessem blauen Prinzip Lasurit, aus dem der für damalige Zeiten kostbarste Farbstoff Ultramarin ("Der Farbstoff aus Übersee") gewonnen wurde. Er spielt auch bei der Gestaltung des Bildes vom Mädchen mit dem Perlohrring eine zentrale Rolle. Bezüglich der Herstellung von Ultramarin wird die Autorin Tracy Chevalier allerdings etwas ungenau - obwohl sie sich sicherlich mit Hintergrundinformationen gut versorgt hat. Vermeer bereitete sich die damals kostbarste Farbe sicherlich nach einem Verfahren, das wir in einer eigenen Webseite vorstellen und das für einen Roman viel zu kompliziert ist und sicherlich seinen Rahmen gesprengt hätte.
Maler als Chemiker
Manche Maler waren aber auch richtige Chemiker. Sie konnten viele Substanzen
stofflich verändern und dabei neue Farbtöne zaubern.
Das gilt zum Beispiel für die Farben auf Bleioxidbasis. Erhitzt man schwarzbraunes Blei(IV)-oxid, so bekommt man nacheinander die Farben Orangerot (Blei(II,IV)-oxid, Mennige) sowie Gelb (Blei(II)-oxid, Bleiglätte). Geht man vorsichtig vor, so erhält man im Reagenzglas die Farbenkombination Schwarz-Weiß-Rot - die deutschen Nationalfarben. Darüber berichten wir in der o. a. Webseite.
Aber auch Elfenbein ("Bein") wurde erhitzt, allerdings bis es verkohlt war. Das war eine ziemlich stinkende Angelegenheit. Den Rückstand verrieb man zu einer besonders prächtigen schwarzen Farbe auf Rußbasis.
Wie man Ocker brannte
Beim Erhitzen von Eisenverbindungen stellten die Maler früher ockerfarbene sowie
braune bis tiefrote Pigmente her. In dem o. a. Buch wird das kurz erwähnt: Der Maler
Jan Vermeer "brannte Ocker im Feuer".
Das wollen wir untersuchen. Wir gehen dazu von Eisenvitriol aus. Darunter versteht man heute Eisen(II)-sulfat-Heptahydrat FeSO4 · 7 H2O (besser geschrieben als Komplex: [Fe(H2O)6]SO4 · H2O). Das gab es schon damals in großen Mengen. Man nutzte dieses natürliche Mineral ("Grüner Vitriol", heute auch "Grünsalz" genannt) unter anderem zur Herstellung von Schwefelsäure. Das Wort Vitriol kommt aus dem Lateinischen vitrum und meint "Glas" - aufgrund der glasartigen Struktur dieser Mineralien. Heute bezeichnet man Vitriole als Salzhydrate.
|
Versuch 1: Erhitzen von Eisensulfat zur Herstellung von Farbpigmenten
|

Bild 1 (Foto: Daggi)
Je nachdem, wie lange wir erhitzen, vertiefen sich auch die Farbtöne. Zunächst
erhalten wir ein helles Ocker, das sich in verschiedenste Brauntöne umwandelt. Das denkbare
Rot von Eisen(III)-oxid erhalten wir hierbei leider nicht. Wenn man diese Farbpigmente in
Wasser aufnimmt, so werden sie wieder ockerfarben. Diese Farbstoffe sind stabil und
können nach Mörsern und Aufschwemmen zum Malen genutzt werden.
Bei der Herstellung muss aber beachtet werden, dass die Farbtöne zunächst eine
hitzebedingte Farbvertiefung zeigen und beim Abkühlen umgekehrt eine
Farbaufhellung. Man spricht von Thermochromie. Aus diesem Grunde erfordert die
Herstellung eines gewünschten Farbtons viel Erfahrung und chemisches
Fingerspitzengefühl! (Das Phänomen beobachten wir auch, wenn wir die Bleioxide
erhitzen.) Deshalb wird während des kräftigen Erhitzens ab und zu eine kleine Probe entnommen,
die man abkühlt und auf weißem Untergrund bei Licht untersucht. Zuletzt ist das heiße Pulver
schwarzbraun, wird beim Abkühlen aber tiefbraunrot.
Die so gewonnenen Pigmente zermörsern wir fein und rühren sie mit Leinöl an. Damit können wir richtig malen. Das Aushärten der Farbe bzw. des Leinöls dauert allerdings eine Zeit (-> Versuch). Aber das Aushärten wird gefördert durch die Schwermetalle in den Pigmenten - hier also durch die Eisen-Ionen. Die sind nämlich Katalysatoren für die Oxidation, bei der die Moleküle des Leinöls quervernetzt werden und eine feste Haut bilden. Wegen der Oxidation muss man Leinöl ohne Antioxidantien wie Vitamin E oder fettlösliche Ascorbinsäure-Verbindungen nehmen! Ansonsten härtet Leinöl nicht aus.
Lässt man das gebrannte Pulver einige Tage lang offen stehen, so wird es manchmal gummiartig fest, da es Wasser zieht. Es lässt sich mit etwas Wasser aber leicht in eine Aufschlämmung verwandeln. Mit der kann man auch schon malen, wie mit Wasserfarben aus dem Tuschkasten. (Wie man Wasserfarben herstellt, berichten wir im nächsten Monatstipp.)
Vielfarbige Pigmente auf Eisenoxid-Basis nutzten übrigens schon die Steinzeitmenschen. Damit malten sie unter anderem auch die Höhlenbilder von Lascaux aus. Die Pigmente fanden sie als Verwitterungsrückstände von Eisenverbindungen, die im Kalkmergel vorkommen (siehe das nächste Bild).

Bild 2: Farbige Eisenmineralien
Links: Limonit (verwitterte Markasitknolle; Kreidezeit)
Rechts: Eisen(III)-oxid (verwitterter Phosphateisenstein; Braunjura)
(Foto: Daggi)
Die Umrisse ihrer Figuren malten sie mit Ruß, den sie wie die späteren Malprofis ebenfalls durch
Erhitzen von Knochen herstellten. Sie nutzten dazu aber auch Braunstein (Mangandioxid), ein
schwarzbraunes Mineral, das sie mit Tierfett anrührten.
Wie und warum sich Vitriole zersetzen
Was chemisch abläuft, zeigt der folgende Versuch.
|
Versuch 2: Zersetzen von Eisenvitriol im Reagenzglas
|
Die Reaktion ist ziemlich kompliziert, da dabei auch das Eisen(II) zu Eisen(III) oxidiert wird.
2 FeSO4 · 7 H2O + ½ O2 ———> Fe2O3 + 2 H2SO4 + 12 H2O
Auch andere Vitriole zersetzen sich in der Hitze, wie das von Kupfer und das von Zink.
|
Versuch 3: Zersetzen von Kupfervitriol
|
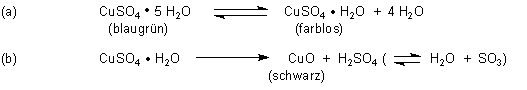
Die erste Wasserabspaltungsreaktion (a) ist leicht umkehrbar. Darauf beruht ein klassischer Wassernachweis. Die Abspaltung der Schwefelsäure (b) ist nicht so einfach rückgängig zu machen.
(Zum genauen Aufbau von Kupfervitriol klicke hier.)
|
Versuch 4: Zersetzen von Zinkvitriol
|
Genauso reagiert auch Aluminiumsulfat Al2(SO4)3 · 18 H2O (oder Alaun, wenn man kein Aluminiumsulfat hat). Allerdings zeigt Aluminiumoxid keine Thermochromie.
Aber nicht alle Vitriole (besser sagen wir von nun an Salzhydrate) zersetzen sich unter Bildung der zugrunde liegenden Metalloxide. So spalten die Salzhydrate von Calciumsulfat (Gips) und von Natriumsulfat (Glaubersalz) zwar auch ihr Hydratwasser ab, aber keine Schwefelsäure.
|
Versuch 5: Erhitzen von weiteren Salzhydraten
|
Es bildet sich keine Schwefelsäure. Die zurückbleibenden Sulfate von Calcium und Natrium sind folglich stabil.
Hier ist die Erklärung für das unterschiedliche Verhalten: Bei der Vitriolzersetzung der ersten drei Versuche spielen die Metallanteile Eisen, Kupfer, Zink und Aluminium die Rolle von Katalysatoren. Deshalb zersetzen sie sich viel rascher als die Hydrate von Calcium- und Natriumsulfat. Diese spalten erst bei wesentlich höheren Temperaturen Schwefeltrioxid, das Anhydrid der Schwefelsäure, ab.

Bild 3: Erhitzen von Vitriolen und Salzhydraten.
Von links nach rechts: Eisen(II)-sulfat-Heptahydrat,
Kupfer(II)-sulfat-Monohydrat,
Kupfer(II)-sulfat-Pentahydrat,
Zink(II)-sulfat-Heptahydrat,
Natriumsulfat-Decahydrat,
Aluminiumsulfat-18-Hydrat
(Foto: Daggi)
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 06. April 2011, Dagmar Wiechoczek