Prof. Blumes Tipp des Monats Oktober 2005 (Tipp-Nr. 100)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Ammoniumacetat -
das symmetrische Säure/Base-Paar
Es gibt Alltags-Chemikalien, an denen sich besonders viele Prinzipien der Chemie erlernen und verstehen lassen. Eine davon ist Ammoniumacetat. Es handelt sich um ein Salz der Essigsäure mit der chemischen Formel
oder in Ionenschreibweise
Ammoniumacetat wird in jedem Chemikalien-Katalog angeboten. Vorsichtig! Es ist hygroskopisch und muss deshalb in gut schließenden Gefäßen aufbewahrt werden. Seine Zusammensetzung können wir mit schulischen Mitteln leicht herausfinden.
|
Versuch 1: Analyse von Ammoniumacetat
|
Die Basis für die Nachweis-Reaktionen wird durch die folgenden Gleichungen beschrieben.
2 CH3-COONH4 + H2SO4 ———> 2 CH3-COOH + (NH4)2SO4
CH3-COONH4 + NaOH ———> CH3-COONa + NH3 + H2O
Wir können Ammoniumacetat herstellen, indem wir Essigsäuredampf mit gasförmigem Ammoniak in Kontakt bringen.
|
Versuch 2: Bildung von Ammoniumacetat
|

Bild 1 (Foto: Daggi)
CH3-COOH + NH3 ———> CH3-COONH4
Das erinnert an die jedem Schüler bekannte Reaktion zwischen den Gasen HCl und NH3.
NH3 + HCl ———> NH4Cl
Zeigt Ammoniumacetat beim Erhitzen vielleicht auch wie das Ammoniumchlorid den bekannten Zerfall in die Ausgangssubstanzen (-> Webseite)? Dass das so sein muss, stellen wir schon fest, wenn wir das Gefäß mit der Substanz öffnen: Das Salz riecht kräftig nach Essig. Und wenn es nach Essig riecht, sollte auch Ammoniak vorhanden sein. Davon riechen wir aber nichts. Offenbar überdeckt der Essiggeruch den des Ammoniaks. Die Anwesenheit von Ammoniak können wir aber anders überprüfen. Vor allem brauchen wir gar nicht zu erwärmen. Das Ganze funktioniert schon bei Zimmertemperatur.
|
Versuch 3: Zerfall von Ammoniumacetat
|

Bild 2: Zersetzung von Ammoniumacetat
(Foto: Daggi)
Man muss sich klar machen: Gerochen haben wir Essig, angezeigt wird uns vor allem Ammoniak. Der Versuch
lehrt uns, dass wir uns nicht auf unsere Sinne verlassen können. Dafür hat die Chemie objektive
Nachweisreaktionen entwickelt.
Fragt sich nur, warum das Papier nicht neutrale Reaktion anzeigt. Denn es sollte ja genauso viel Ammoniak im Gasraum sein wie Essigsäuredampf. Das liegt daran, dass Ammoniak wesentlich besser in Wasser löslich ist als Essigsäuredampf.
Ammoniumacetat wird in der Gärungsindustrie als Futter für die Mikroorganismen
genutzt.
Das Letztere verwundert ein wenig: Denken wir an Acetat, so fällt uns das Stichwort "Protolyse" ein.
Lösungen von Natriumacetat zum Beispiel reagieren deshalb ziemlich alkalisch. Das entstehende alkalische
Milieu sollte die meisten Mikroorganismen in ihrem Wachstum und in ihrer Tätigkeit hemmen.
|
Versuch 4: Protolyse von Natriumacetat
|
Hier ist die Gleichung für die Protolyse-Reaktion, genau genommen für ein Protolyse-Gleichgewicht. (Die Natrium-Ionen haben wir weggelassen, da sie am Protolyse-Geschehen nicht teilnehmen.)
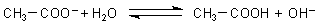
Dahinter steckt die
Protolyse-Regel Nr. 1:
Lösungen von Salzen zwischen einer schwachen Säure und einer starken Base reagieren alkalisch.
Gilt das auch für Ammoniumsalze? Ammoniaklösungen reagieren doch auch alkalisch. Zunächst nehmen wir Ammoniumchlorid.
|
Versuch 5: Protolyse von Ammoniumchlorid
|
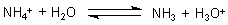
(Das überrascht eigentlich nicht: Ammoniumchlorid ist das säuernde Prinzip von Lakritz.)
Anders als Essigsäure ist HCl eine starke Säure, Ammoniak eine schwache Base. Es folgt die
Protolyse-Regel Nr. 2:
Lösungen von Salzen zwischen einer schwachen Base und einer starken Säure reagieren sauer.
Wenn wir den pH-Wert einer wässrigen Lösung von Ammoniumacetat messen,
erleben wir eine Überraschung.
|
Versuch 6: Der pH-Wert von Ammoniumacetat
Wir müssen deshalb ein pH-Meter verwenden. Damit messen wir für die Lösung von Ammoniumacetat einen pH-Wert von 7,1. Hinweis: Wir dürfen nicht erwarten, dass wir genau pH-Wert 7 messen, weil das Wasser normalerweise CO2 oder Ammoniak enthalten kann und deshalb schwach sauer oder alkalisch reagiert. Außerdem sind pH-Wert-Messungen um pH 7 immer heikel, wenn es sich gerade nicht um Pufferlösungen handelt, die hier ihren Pufferbereich haben. |
Die Lösung von Ammoniumacetat reagiert neutral!
Beim Ammoniumacetat handelt es sich um eine Verbindung zwischen einer schwachen Base (Ammoniak) und einer schwachen Säure (Essigsäure). Können wir nun Regel 3 für Protolyse-Gleichgewichte hinschreiben: "Lösungen von Salzen einer schwachen Base und einer starken Säure reagieren neutral."? Leider können wir das nicht.
Wenn wir herausfinden wollen, warum der pH-Wert einer Lösung von Ammoniumacetat 7 beträgt, können wir ja zum Beispiel mal Ammoniumchlorid und Natriumacetat mischen. Das erste reagiert ja sauer, das andere alkalisch. Vielleicht neutralisieren sich die beiden Säure/Base-Gleichgewichte
CH3-COOH / CH3-COO- und NH4+ / NH3
gegenseitig? Das ist tatsächlich der Fall.
|
Versuch 7: Die Protolyse einer Mischung von Natriumacetat und von Ammoniumchlorid
|
Wir können den zu erwartenden pH-Wert sogar ausrechnen. Wir müssen nur die pH-Werte der Ausgangslösungen addieren und durch 2 dividieren.
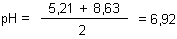
Wenn jemand Ammoniumacetatlösungen herstellen will, benötigt er nur gleiche (molare) Mengen an Natriumacetat und an Ammoniumchlorid. (Bei der geplanten Verwendung darf aber Natriumchlorid nicht stören.)
Den Versuch 7 können wir auch in die Form einer Gleichung bringen. Hier sind zunächst die Protolyse-Gleichungen.
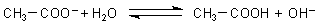
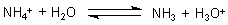
(Die Natrium- und Chlorid-Ionen brauchen wir nicht zu berücksichtigen, da diese nicht am Geschehen beteiligt sind.)
Im Experiment haben wir beide Reaktionssysteme vermischt. Also addieren wir auch die beiden Gleichungen.
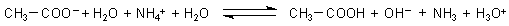
Diese Gesamtgleichung können wir vereinfachen. Mit der Neutralisationsgleichung
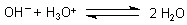
folgt daraus
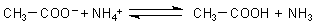
Hier reagiert also genau genommen das Acetat-Anion (eine Base) mit dem Ammonium-Ion (einer Säure). Dies ist eine klassische Brönsted-Säure/Base-Reaktion. Das Bemerkenswerte ist, dass wir das Wasser hierbei letztlich nur als Lösemittel benötigen.
Wie die resultierende Misch-Lösung reagiert, ist eine Frage der relativen Stärke der beiden beteiligten Säure/Base-Systeme. Das ist prinzipiell richtig.
Aber hier kommt noch ein kleines chemisches "Wunder" hinzu:
Ammoniak und Essigsäure sind - was ihre Stärke angeht - chemische Spiegelbilder.
Vorsicht - hier wird gerechnet!
Die Stärke von schwachen Säuren und Basen beschreibt man durch ihre Dissoziationskonstanten.

Anstelle der Gleichgewichtskonstanten nimmt man gerne die pK-Werte, also deren negativen dekadischen Logarithmus. Der pK-Wert entspricht dem pH-Wert, bei dem die schwachen Elektrolyte zu 50 % dissoziiert sind. Bei Säuren formuliert man die pKa-Werte (a steht für Acidum), für Basen die pKb-Werte (b steht für Basis - historisch entwickelt aus der Bezeichnung "Grundlage für die Neutralisation von Säuren").
Hier sind die pK-Werte, die man in Tabellenwerken leicht finden kann:
| Essigsäure: | pKa = 4,75 |
| Ammoniak: | pKb = 4,75 |
Sie sind vom Zahlenwert her identisch! Die Werte von pKa und pKb (wohlgemerkt definiert für ein- und dasselbe Säure/Base-System wie NH3/NH4+ oder HAc/Ac-!) können Laien nur schlecht vergleichen. Sie hängen aber über folgende Gleichung zusammen:
pKa + pKb = 14
(Diese Gleichung entspricht der Beziehung
pH + pOH = 14
Sie folgt direkt aus dem Ionenprodukt des Wassers.)
Dann gilt für die pKa-Werte, mit denen die Dissoziation von CH3-COOH bzw. von NH4+ beschrieben wird:
| Essigsäure: | pKa = 4,75 |
| Ammonium-Ion: | pKa = 14 - 4,75 = 9,25 |
Anschaulich heißt das konkret, dass die Essigsäure die stärkere Säure ist, denn sie gibt schon bei pH 4,75 die Hälfte ihrer Protonen ab. Das macht das Ammonium-Ion erst bei pH 9,25, wenn also genügend OH--Ionen vorhanden sind.
Natürlich kann man das Ganze auch für die pKb-Werte durchrechnen. Mit denen beschreiben wir die Protonierung von Acetat-Ionen bzw. von NH3. Statt in pH-Werten müssen wir dann auch in pOH-Werten denken.
| Acetat-Ion: | pKb = 14 - 4,75 = 9,25 |
| Ammoniak: | pKb = 4,75 |
Das heißt, dass Ammoniak die stärkere Base ist, denn sie hat schon bei pOH 4,75 (oder bei pH 9,25) die Hälfte ihrer Protonen aufgenommen. Das macht das Acetat-Ion erst bei pOH 9,25 (oder bei pH 4,75), wenn also genügend H+-Ionen vorhanden sind.
Mischt man nun Lösungen von Essigsäure und Ammoniak im molaren Verhältnis 1:1, so folgt daraus für den pH-Wert der Mischung
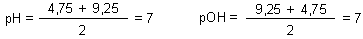
Dass diese Überlegungen stimmen, haben wir in den Versuchen 6 und 7 mit unseren Messungen gezeigt.
Halten wir fest: Die dritte Regel der Protolyse ist viel komplizierter als die ersten zwei Regeln erwarten lassen.
Protolyse-Regel Nr. 3:
Lösungen von Salzen einer schwachen Base und einer schwachen Säure reagieren neutral - aber nur,
wenn es sich um symmetrische Säure/Base-Systeme wie beim Ammoniumacetat handelt.
Ansonsten reagieren sie schwach alkalisch oder schwach sauer - je nachdem, wer stärker ist, die schwache
Base oder die schwache Säure.
Fazit
Wenn wir also Mikroorganismen, die für uns in großen Bottichen ("Fermenter") Gärungsprozesse betreiben, mit
Ammoniumacetat füttern, sind die mehr als zufrieden. Sie bekommen nicht nur Kohlenstoffverbindungen sowie auch
Stickstoff zum Aufbau ihrer Biomoleküle. Acetat ist darüber hinaus noch ein vorzüglicher Energiespender.
In diesem Zusammenhang ist interessant, dass Ammoniumacetat im chemischen Labor gern als
Puffersubstanz genutzt wird. Bemerkenswert ist, dass Ammoniumacetat zwei
Pufferbereiche hat. Diese erkennen wir, wenn wir eine potentiometrische Titrationskurve einer Ammoniumacetatlösung
aufnehmen (-> Versuch). Um auch den Pufferbereich der Essigsäure zu erfassen,
müssen wir das Salz in äquimolarer Salzsäure lösen.
Das folgende Bild zeigt die Titrationskurve.
| Klick mich an! |
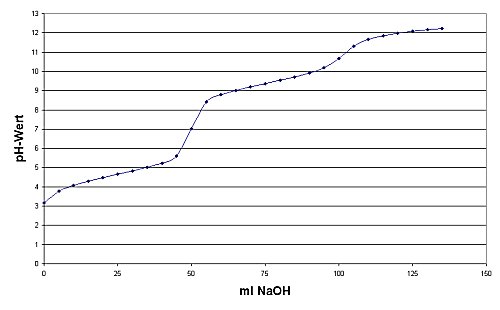 |
| Bild 3: Titrationskurve von Ammoniumacetat
(Bedingungen siehe Versuch) |
Wir erkennen die beiden Pufferbereiche um pH 4,75 und um pH 9,25.
Das ist auch für die Verwendung in der Gärungsindustrie von Nutzen: Ammoniumacetat ist nicht nur ein neutraler Nährstoff für die Bakterien, sondern zugleich ein Puffer, der vor dem Abgleiten in saures oder alkalisches Milieu schützt.
Nun verstehen wir auch, warum man gegen Verätzungen der Atemwege durch Ammoniakgas als Gegenmittel Dämpfe von verdünnter Essigessenz (das ist ca. 15%ige Essigsäurelösung) einatmen soll. Dabei läuft alles entsprechend dem Versuch 2 ab; es bildet sich neutrales Ammoniumacetat.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. August 2008, Dagmar Wiechoczek