Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Januar 2018 (Tipp-Nr. 247)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Was genau passiert bei der Flammenfärbung von Buntfeuer?
Rüdiger Blume
Was wäre ein Feuerwerk ohne Flammenfärbung? Bild 1: Nachbarliches Neujahrs-Feuerwerk 2018
Grundlage dafür ist, dass bestimmte Salze und Metallverbindungen beim Erhitzen in einer offenen Flamme typische Farben zeigen. Man spricht von Buntfeuer. Die Flammenfärbung ist darüber hinaus eine wichtige Vorprobe bei chemischen Untersuchungen. Dazu erhitzt man eine Stoffprobe mit Hilfe eines Magnesia-Stäbchens oder eines Platin-Drahts mit einem Bunsenbrenner. (Wie man das am besten macht, erklären wir hier). Bild 2: Kalium-Flammenfärbung
Viele Anfragen beschäftigen sich daher mit der Flammenfärbung. Der Schwierigkeitsgrad der Fragen geht von einfach bis kompliziert. Fangen wir beim Einfachen an: Frage einer Siebtklässlerin: Frage einer Siebtklässlerin: Wir haben ein rätselmärchen gelesen, welches wir nicht lösen können: eine böse hexe hält dich gefangen, sie hat 2 weisse salze, kaliumiodid (hochgiftig!) und natriumchlorid. Die lösung eines der beiden salze muss man trinken, man darf die lösung selber herstellen und verwendung von 3 geräten und wasser. Können sie mir auf die sprünge helfen? Ich weiss nicht weiter! Antwort: Die beiden Salze lassen sich mit Hilfe der Flammenprobe über ihre Kationen sehr einfach unterscheiden (Natrium: leuchtend gelbe Flammenfärbung, Kalium: violett). Als die drei Geräte empfehle ich daher: Gasflasche, Brenner und Magnesia-Stäbchen.

(Fotos: Blume)
(Foto: Dagmar)
Übrigens: Kalium-Iodid ist nicht hochgiftig…Trotzdem darfst du im chemischen Labor auf keinen Fall etwas trinken! Die Hexe, die diese Aufgabe erfunden hat, ist wirklich böse und gemeingefährlich.
Zurück zum Thema: Das Leuchten von energetisch angeregten Substanzen hat der dänische Physiker Niels Bohr untersucht. Er hat sein bekanntes, nach ihm benanntes Atommodell hinsichtlich des Licht-Absorptions/Emissions-Verhaltens von Wasserstoff entwickelt, also von Gasen. Dabei ging er von freien Atomen aus. Licht wird nach seiner Theorie von freien Atomen ausgestrahlt, wenn ihre Elektronen von höheren Energie-Niveaus auf tiefere fallen. Die Energiedifferenz ist die Energie des abgestrahlten Lichts. Sie ist abhängig von der Wellenlänge λ bzw. der Frequenz ν des Lichts:
E = h · c / λ = h · ν (h = Plancksches Wirkungsquantum; c = Lichtgeschwindigkeit)
Umgekehrt wird Licht der gleichen Wellenlängen vom Atom absorbiert.
Soweit – so gut. Jetzt tritt für Schüler aber eine Verständnis-Schwierigkeit auf: Sie werden erstmals mit diesen Lichtemissionen konfrontiert, indem sie nicht Gase, sondern feste Salze von Alkali- oder schwereren Erdalkalimetallen (bzw. deren Lösungen) in einer Brennerflamme erhitzen. Dass dies ein Problem ist, zeigen immer wieder diesbezügliche Anfragen von Schülern.
Welche Schritte laufen ab bei der Anregung eines Metall-Kations aus einem Salz durch eine Brennerflamme?
Wird das Salz oder das Kation tatsächlich in den gasförmigen und atomaren Zustand überführt; reichen dazu die Temperaturen? Was passiert dabei mit dem Anion, warum geben nur bestimmte Salze eines Metalls eine gut sichtbare Färbung?
Wo aber kommen beim Erhitzen von Salzen die Elektronen für die Metall-Kationen her?
Punktuell werden in einer Brennerflamme weit über 2000 °C erreicht. Das reicht aus, um auch Salze zu verdampfen. So bilden sich z. B. nachweislich gasförmige NaCl-Moleküle.
Dabei wird diejenige Redoxreaktion, die zur Bildung des Salzes führte, umgekehrt.
(1) Bildung aus den Elementen:
Na + ½ Cl2 ———> Na+ + Cl- + Energie
(2) Flammenfärbende Rückreaktion:
Na+ + Cl- + Wärme-Energie ———> (über Na-Cl) ———>Na + ½ Cl2 + Lichtenergie
Diese Reaktionen laufen auch im Feuerwerk ab. Die Hitze dazu liefern Nitrate und andere, leicht entzündliche oder verbrennungsfördernde Substanzen.
Erhitzen von Kupfer und seinen Verbindungen
Ein anderes Beispiel ist die blaugrüne Flamme, die man beim Erhitzen von Kupferchlorid erhält. Die gleiche Flammenfärbung sieht man beim Erhitzen von Kupfermetall in Gegenwart von chlorhaltigem Material (Beilsteinprobe). Am Kupfer können wir erklären, welchen Einfluss Anionen auf die Lichtemission haben. Denn nicht alle Kupferverbindungen zeigen eine blaugrüne Flamme!

Bild 3: Beilsteinprobe
(Foto: Dietmar)
Auch beim Kupfer müssen zur Erzeugung von Buntfeuern gasförmige Ionen bzw. -Verbindungen vorliegen.
Kupfermetall selbst zeigt deshalb beim Erhitzen keine Flammenfärbung, sondern nur die Strahlung eines erhitzten, sogenannten Schwarzen Strahlers. Cu-Oxid könnte sehr wohl eine Flammenfärbung zeigen; die Konzentration von Cu-Oxid sowie von Kupfer-Ionen ist im Dampf aber zu gering, als dass eine Flammenfärbung zu erkennen wäre. Grund: Das beim Erhitzen an der Luft entstehende Kupfer-Oxid haftet so stark auf dem Metall, dass nichts verdampft. Außerdem ist Kupfer-Oxid sehr stabil; der Sauerstoff zeigt keine Tendenz, seine Elektronen an das Kupfer-Kation zurückzugeben, wodurch die Flammfärbung entstehen könnte.
Das gilt auch für Kupfer(II)-sulfat-pentahydrat, das beim Erhitzen in der Brennerflamme keine merkliche blaugrüne Färbung hervorruft. Dessen Sulfat-Anion ist so stabil, dass kein Elektronenaustausch mit dem Kupfer-Ion stattfindet. Es dampfen eher Wassermoleküle, Schwefelsäure oder SO3 ab. Zurück bleibt wieder CuO.
Anders ist das bei den leichter verdampfenden Kupfer-Halogeniden wie CuCl2, das bereits in kleinen Konzentrationen einen starken Leuchteffekt zeigt. Es laufen dabei Reaktionen wie beim NaCl beschrieben ab. Aus diesem Grunde gibt man bei der Flammprobe zu Kupfermetall sowie zu nicht halogenischen Kupfersalzen wie dem Sulfat bzw. Kupfer-Verbindungen wie dem Oxid etwas Salzsäure hinzu.
Zur Beilsteinprobe: Diese dient zum Nachweis von halogenierten organischen Verbindungen wie dem PVC. Dabei werden beim Erhitzen HCl-Moleküle abgespalten, die mit Kupfer bzw. CuO unter Bildung von flüchtigem Cu-Chlorid reagieren.
Last but not least ist noch eine andere Elektronenquelle zu diskutieren
Bei den hohen Flammentemperaturen schwirren im Flammengas Brenngas-Kationen und Elektronen nebeneinander herum – man spricht von einem Plasma. Auch diese Elektronen können von den Metall-Kationen aufgenommen werden, wobei es zu Licht-Emissionen kommt.
Von bunten Flammen zum Bohrschen Atommodell
Wenn man die bunten Flammen mit einem Spektroskop untersucht, kann man das Ergebnis in Bezug mit dem Bohrschen Atommodell bringen: Man stellt fest, dass man (anders als etwa beim Zerlegen von weißem Licht einer Glühlampe) kein kontinuierliches Spektrum sieht, sondern scharfe Linien.
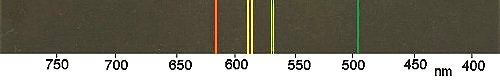
Bild 4: Emissions-Spektrum von Natrium
Das Auftreten von Linien erklärte Niels Bohr wie folgt: Wären die Elektronen beliebig um ein Atom verteilt, so wäre ein kontinuierliches Spektrum die Folge. Da sie aber bestimmte von der Natur vorgeschriebene Bahnen (Orbitale) einnehmen, sind auch die Energiedifferenzen vorgegeben. Diese Energiepäckchen nennt man Quanten. Niels Bohr hat aus diesem spektralen Verhalten auf das Vorliegen von definierten Bahnen geschlossen und konnte so sein Atommodell entwickeln.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 16. Januar 2018, Fritz Meiners