 |
| (Foto: Daggi) |
Die Zersetzung von Citronensäure
Experimente:
Versuch: Thermische Zersetzung von Citronensäure
Versuch: Oxidative Decarboxylierung von Citronensäure durch Kaliumpermanganat
Versuch: Reaktion von Cerammonium-Reagenz mit Citronensäure
Versuch: Die elementare Zusammensetzung der Citronensäure
 |
| (Foto: Daggi) |
Versucht man, Citronensäure thermisch zu zersetzen, um z. B. durch Verkohlen das Vorliegen des Elements
Kohlenstoff nachzuweisen, erlebt man eine Überraschung: Die Citronensäure schmilzt beim Erhitzen
zunächst in ihrem Kristallwasser. Anfänglich finden wir nur Wasser und CO2 in der Vorlage
(-> Versuch). Dann dampft der Rest fast völlig ab (-> Versuch).
Es bilden sich offenbar flüchtige Zersetzungsprodukte, die sich zum Teil in der Vorlage allerdings wieder als weiße Masse
verfestigen. Darunter befinden sich ungesättigte Verbindungen, solche mit Methylgruppen und
außerdem Aldehyde und Säuren.
Der Mechanismus verläuft über die Aconitsäure, die auch aus dem Citronensäure-Zyclus bekannt
ist:
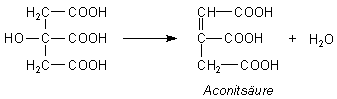
Die Aconitsäure zersetzt sich zu Aldehyden, Ketonen, ungesättigten Verbindungen und niedermolekularen Säuren sowie last but not least zu Wasser und CO2.
Bildung von Aceton aus Citronensäure durch oxidative
Decarboxylierung
Diese grobe Zersetzungsreaktion kann man auch schonender durchführen. Citronensäure wird
nämlich in Gegenwart von starken Oxidationsmitteln wie Kaliumpermanganat (-> Versuch)
sowie Cer(IV)-Verbindungen (-> Versuch) zersetzt.
Bei dieser Zersetzung entstehen je nach Temperatur unterschiedliche Produkte:
Während bei Temperaturen unter 60 °C u. a. Formaldehyd, Ameisensäure und Kohlenstoffdioxid entstehen, bilden sich bei höherer Temperatur in erster Linie Aceton und Kohlenstoffdioxid. Diese Reaktion läuft über mehrere Schritte ab:
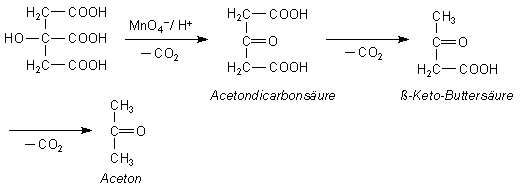
Die Tatsache, dass je nach Reaktionstemperatur unterschiedliche Produkte entstehen, lässt sich dadurch erklären, dass als Zwischenprodukt der Reaktion Acetondicarbonsäure (= 3-Keto-Glutarsäure) entsteht. Diese zerfällt bei hoher Temperatur als typische ß-Carbonsäure sehr schnell unter Bildung von ß-Keto-Buttersäure. Die ist genauso instabil wie die Acetondicarbonsäure; sie bildet deshalb spontan Aceton und Kohlenstoffdioxid, während bei niedrigen Temperaturen das Kohlenstoffgerüst langsamer, aber effektiver oxidativ abgebaut wird.
Zum Zerfall von ß-Ketosäuren
Bemerkenswert ist, dass die intermediär auftretende ß-Keto-Buttersäure auch bei der
Pathophysiologie der Zuckerkrankheit eine Rolle spielt. Sie liegt zunächst bei der
Fettsäuresynthese am Multienzymkomplex gebunden vor. In diesem Zustand wird sie zu
Hydroxybuttersäure reduziert. Reduktionsmittel ist NADPH. Bei Insulinmangel fehlt NADPH,
damit entfällt auch die Reduktion; die ß-Keto-Buttersäure wird abgestoßen. Wie alle freien
ß-Ketosäuren (z. B. Acetondicarbonsäure oder die im Citronensäure-Zyclus aus der Iso-Citronensäure
intermediär gebildete instabile Oxalbernsteinsäure) neigt sie
zur spontanen Decarboxylierung unter Bildung einer Ketoverbindung, wobei in diesem Fall Aceton gebildet
wird. Aceton ist als Fettlösemittel toxisch für das Zentralnervensystem und wirkt narkotisierend;
die Kranken fallen ins bekannte Koma.
Weitere Texte zum Thema „Zitrone“